题目内容
17.下列说法正确的是( )| A. | 在常温常压下,1mol氦气含有的分子数为NA | |
| B. | 在常温常压下,11.2L氯气含有的分子数为0.5NA | |
| C. | 15.6gNa2O2与过量CO2反应时,转移的电子数为NA | |
| D. | 将4gNaOH溶于1L水中,可得到0.1mol/LNaOH溶液 |
分析 A.1mol氦气含有1mol分子;
B.不是标准状况下,不能使用标况下的气体摩尔体积计算11.2L氯气的物质的量;
C.15.6g过氧化钠的物质的量为0.2mol,0.2mol过氧化钠与足量二氧化碳反应生成0.1mol氧气,转移了0.2mol电子;
D.溶液的体积大于1L.
解答 解:A.1mol氦气含有的分子数为NA,故A正确;
B.常温下,不是标况下,题中条件无法计算11.2L氯气的物质的量,故B错误;
C.常温常压下,15.6g Na2O2的物质的量为0.2mol,0.2mol过氧化钠与过量的CO2反应时生成了0.1mol氧气,转移了0.2mol电子转移的电子数为0.2NA,故C错误;
D.溶液的体积大于1L,浓度小于0.1mol/L,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的判断及计算,题目难度中等,注意明确标况下气体摩尔体积的使用条件,熟练掌握阿伏伽德罗常数与物质的量之间的转化关系.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
5.下列各组物质中,都是共价化合物的是( )
| A. | H2S和Na2O | B. | H2O2和NH4Cl | C. | NH3和N2 | D. | HNO3和HClO3 |
12.现有如下各说法:
①在水中氢、氧原子间均以化学键相结合.
②金属和非金属化合形成的化学键必为离子键.
③离子键是阳离子、阴离子的相互吸引.
④元素的非金属性越强,其构成的单质越活泼.
⑤H2分子和Cl2分子的反应过程是H2、Cl2分子里共价键发生断裂生成H、Cl原子,而后H、Cl原子形成离子键的过程.
上述各种说法正确的是( )
①在水中氢、氧原子间均以化学键相结合.
②金属和非金属化合形成的化学键必为离子键.
③离子键是阳离子、阴离子的相互吸引.
④元素的非金属性越强,其构成的单质越活泼.
⑤H2分子和Cl2分子的反应过程是H2、Cl2分子里共价键发生断裂生成H、Cl原子,而后H、Cl原子形成离子键的过程.
上述各种说法正确的是( )
| A. | ①②⑤正确 | B. | 都不正确 | ||
| C. | ④正确,其他不正确 | D. | 仅①不正确 |
2.下列离子方程式正确的是( )
| A. | 向硫酸铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓ | |
| B. | 向Ba(OH)2溶液中滴加NaHSO4溶液至混合溶液恰好为中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | FeSO4溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+=2Fe3++2H2O | |
| D. | 向NaHCO3溶液中加入足量Ba(OH)2的溶液:Ba2++2HCO3-+2OH-=2H2O+BaCO3↓+CO32- |
7.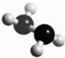 肼(N2H4)是火箭燃料,其分子的球棍模型如图所示.肼能与H2O2发生反应:N2H4+2H2O2═N2+4H2O.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
肼(N2H4)是火箭燃料,其分子的球棍模型如图所示.肼能与H2O2发生反应:N2H4+2H2O2═N2+4H2O.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
 肼(N2H4)是火箭燃料,其分子的球棍模型如图所示.肼能与H2O2发生反应:N2H4+2H2O2═N2+4H2O.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
肼(N2H4)是火箭燃料,其分子的球棍模型如图所示.肼能与H2O2发生反应:N2H4+2H2O2═N2+4H2O.设NA为阿伏伽德罗常数的值,下列说法正确的是( )| A. | 32g N2H4中含有共价键的总数为6NA | |
| B. | 标准状况下,22.4LH2O2中所含原子总数为4NA | |
| C. | 28g N2中含电子总数为7NA | |
| D. | 与17g H2O2所含非极性键数目相同的N2H4的分子总数为0.5NA |
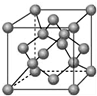 已知A、B、C、D都是元素周期表中前36号的元素.A元素的一种核素没有中子;B的基态原子核外电子有7种不同的运动状态;C元素是无机非金属材料的主角,它的单质可以用作电脑芯片;D元素是地壳中含量第二的金属元素.请回答:
已知A、B、C、D都是元素周期表中前36号的元素.A元素的一种核素没有中子;B的基态原子核外电子有7种不同的运动状态;C元素是无机非金属材料的主角,它的单质可以用作电脑芯片;D元素是地壳中含量第二的金属元素.请回答: