题目内容
18.纯碱一直以来都是工业生产的重要原料,很长一段时间来纯碱的制法都被欧美国家所垄断.上个世纪初我国著名的工业化学家侯德榜先生,经过数年的反复研究终于发明了优于欧美制碱技术的联合制碱法(又称侯氏制碱法).并在天津建造了我国独立研发的第一家制碱厂.其制碱原理的流程如图所示: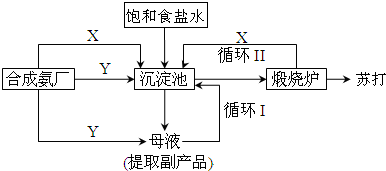
(1)侯德榜选择天津作为制碱厂的厂址有何便利条件(举二例说明)原料丰富、运输方便.
(2)侯氏制碱法的最终产物是(化学式)Na2CO3;其在水溶液中显著的实质是(离子方程式):CO32-+H2O?HCO3-+OH-.
(3)合成氨工厂需要向制碱厂提供两种原料气体,它们分别是:CO2、NH3.这两种气体在使用过程中是否需要考虑添加的顺序?是(填“是”或“否”),原因是氨气在水中的溶解度大,先通氨气后通二氧化碳产生碳酸氢铵多,有利于碳酸氢钠的析出.
(4)在沉淀池中发生的反应的化学方程式是NH4HCO3+NaCl═NaHCO3↓+NH4Cl.
(5)使原料水中溶质的利用率从70%提高到90%以上,主要是设计了循环Ⅰ(填上述流程中的编号)的循环.从母液中可以提取的副产品的应用是做肥料(举一例).
分析 合成氨工厂需要向制碱厂提供两种原料气体,它们分别是二氧化碳和氨气;二氧化碳在水溶液中溶解度小,生成碳酸氢钠少,不能析出晶体,而氨气在水中的溶解度大,先通氨气后通二氧化碳产生碳酸氢铵多,有利于碳酸氢钠的析出,氨化的饱和氯化钠溶液中通入过量二氧化碳,发生反应二氧化碳和氨水反应生成碳酸氢铵,碳酸氢铵和氯化钠反应,由于碳酸氢钠溶解度小,所以先生成碳酸氢钠晶体析出,母液中氯化钠和碳酸氢钠分解生成的二氧化碳可以循环使用,碳酸氢钠分解生成碳酸钠,
(1)而制碱的原料之一NaCl,在海水中含量丰富.
(2)侯氏制碱法的最终产物是碳酸钠,碳酸钠在水溶液中显碱性,是因为CO32-水解.
(3)合成氨工厂需要向制碱厂提供两种原料气体,它们分别是二氧化碳和氨气;二氧化碳在水溶液中溶解度小,生成碳酸氢钠少,不能析出晶体,而氨气在水中的溶解度大,先通氨气后通二氧化碳产生碳酸氢铵多,有利于碳酸氢钠的析出.
(4)氨化的饱和氯化钠溶液中通入过量二氧化碳,发生反应二氧化碳和氨水反应生成碳酸氢铵,碳酸氢铵和氯化钠反应,由于碳酸氢钠溶解度小,所以先生成碳酸氢钠晶体析出,反应方程式为NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl.
(5)碳酸氢钠能溶于水,析出晶体后的溶液中还含有较多碳酸氢钠,所以要循环利用,从母液中有NH4Cl可以做肥料.
解答 解:(1)天津位于沿海地区交通发达,而制碱的原料之一NaCl,在海水中含量丰富,
故答案为:原料丰富;运输方便;
(2)侯氏制碱法的最终产物是碳酸钠,酸钠在水溶液中显碱性,是因为CO32-水解,CO32-+H2O?HCO3-+OH-,故答案为:Na2CO3 ;CO32-+H2O?HCO3-+OH-;
(3)合成氨工厂需要向制碱厂提供两种原料气体,它们分别是二氧化碳和氨气;二氧化碳在水溶液中溶解度小,生成碳酸氢钠少,不能析出晶体,而氨气在水中的溶解度大,先通氨气后通二氧化碳产生碳酸氢铵多,有利于碳酸氢钠的析出;
故答案为:CO2;NH3;是;氨气在水中的溶解度大,先通氨气后通二氧化碳产生碳酸氢铵多,有利于碳酸氢钠的析出;
(4)氨化的饱和氯化钠溶液中通入过量二氧化碳,发生反应二氧化碳和氨水反应生成碳酸氢铵,碳酸氢铵和氯化钠反应,由于碳酸氢钠溶解度小,所以先生成碳酸氢钠晶体析出,反应方程式为:NH4HCO3+NaCl═NaHCO3↓+NH4Cl,
故答案为:NH4HCO3+NaCl═NaHCO3↓+NH4Cl;
(5)碳酸氢钠能溶于水,析出晶体后的溶液中还含有较多碳酸氢钠,所以要循环利用,从母液中有NH4Cl可以做肥料,
故答案为:循环Ⅰ;做肥料.
点评 本题考查了纯碱工业制备原理,反应实质的应用,试剂的作用,理解生产原理和过程的实质是解答的关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | ①② | B. | ②③④ | C. | ①③⑤ | D. | ②⑤ |
| A. | 1 mol Na2O2与水反应,转移电子1 mol | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应的产物也相同 | |
| C. | 钠能与氧气和水反应,钠暴露在空气中最终的产物是NaOH | |
| D. | 将Na2O2加入酚酞试液中,得到红色溶液 |
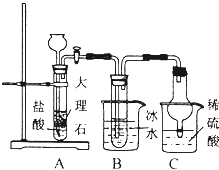 氨气是重要的化工原料.
氨气是重要的化工原料.(1)实验室可用浓氨水和abd(选填编号)快速制取氨气.
a.烧碱 b.生石灰 c.氯化铵d.碱石灰
(2)“侯氏制碱”的核心反应为:
NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3.依据此原理,欲制得碳酸氢钠晶体,某同学设计了如图实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和.
①C装置的作用为防倒吸、吸收过量氨气防污染.
②如表列出的是相关物质在不同温度下的溶解度数据(g/100g水):
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
③该同学在检查完此套装置的气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在AB装置之间(填写字母)连接一个盛有饱和碳酸氢钠溶液的洗气装置,其作用除去二氧化碳气体中的氯化氢气体.
④若该同学进行实验时,所用饱和食盐水中含NaCl的质量为11.7g,实验后得到干燥的NaHCO3晶体的质量为10.92g,则NaHCO3的产率为65%.
(3)往CuSO4溶液中滴加氨水,先有沉淀析出,后沉淀溶解溶液呈深蓝色,有[Cu(NH3)4]2+生成.往溶液中滴加稀硫酸,溶液变为淡蓝色.颜色变浅的原因除溶液变稀外,还可能存在平衡I:[Cu(NH3)4]2+ (深蓝色)+4H+?Cu2+(蓝色)+4NH4+
请设计一个简单实验证明平衡I是否存在往深蓝色溶液中通入少量HCl气体若溶液颜色变浅,证明有平衡Ⅰ的存在,否则不存在(或通入少量氨气或加少量NaOH固体,若溶液颜色变深证明平衡Ⅰ的存在,否则不存在).
| A. | 饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 | |
| B. | 向氯化银的悬浊液中加入氯化钠溶液,氯化银的Ksp减小 | |
| C. | 向0.0008mol•L-1的K2CrO4溶液中加入等体积0.002 mol•L-1的AgNO3溶液,则CrO42-完全沉淀 | |
| D. | 将0.001mol•L-1AgNO3溶液滴入浓度均为0.001 mol•L-1的KCl和K2CrO4混合溶液中,则先产生AgCl沉淀 |
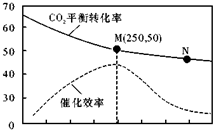 一定条件下合成乙烯6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是( )
一定条件下合成乙烯6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是( )| A. | 生成乙烯的速率:v(M)>v(N) | |
| B. | 平衡常数KM<KN | |
| C. | 催化剂可能会影响CO2的平衡转化率 | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点时,CO2的体积分数约为15.4% |
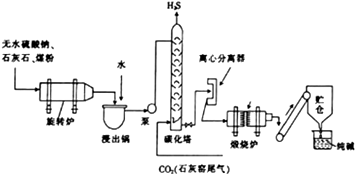 历史上路布兰法生产纯碱的工艺流程如图所示.
历史上路布兰法生产纯碱的工艺流程如图所示.