题目内容
随着工业的迅速发展,废水的种类和数量迅猛增加,对水体的污染也日趋广泛和严重,威胁人类的健康和安全.因此工业废水的处理是当代一个重要的课题.
(1)臭氧是一种强氧化剂,在处理含氰(CN-)废水过程中由于无二次污染,而备受关注.该过程由两步反应组成:CN-(aq)+O3(g)═CNO-(aq)+O2(g)△H12CNO-(aq)+3O3(g)+H2O(l)═N2(g)+2HCO3-(aq)+3O2(g)△H2
总反应的化学方程式为 ,该反应△H= .
(2)工业含磷废水中含大量的PO43-,可通过投放镁盐进行除磷.
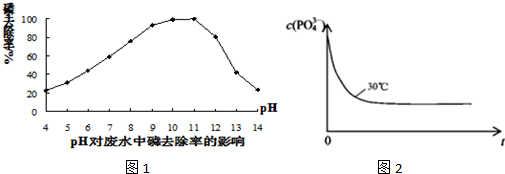
①投放的镁盐让磷酸根形成Mg3(PO4)2沉淀而除磷.如图1显示,沉淀过程的 pH 对废水中磷的去除率影响很大.从如图可知,最佳除磷的pH范围是 .当pH较高时,磷去除率下降的原因是 .
②若处理后的废水中c(Mg2+)=1.0×10-6mol/L时,试计算溶液中的c(PO43-)(写出计算过程,已知Ksp[Mg3(PO4)2]=1.0×10-24)
③若废水中还含有大量的NH4+,投放镁盐,可得到磷酸氨镁晶体(MgNH4PO4?6H2O),可用作化肥.写出该反应的离子方程式 .
④实验表明,其他条件相同时学科王,温度越高,残余磷浓度越高.已知30℃时,c(PO43-)~反应时间t的变化曲线如图2.若保持其他条件不变,请在坐标图中,画出60℃时c(PO43-)~反应时间t的变化曲线示意图.

(1)臭氧是一种强氧化剂,在处理含氰(CN-)废水过程中由于无二次污染,而备受关注.该过程由两步反应组成:CN-(aq)+O3(g)═CNO-(aq)+O2(g)△H12CNO-(aq)+3O3(g)+H2O(l)═N2(g)+2HCO3-(aq)+3O2(g)△H2
总反应的化学方程式为
(2)工业含磷废水中含大量的PO43-,可通过投放镁盐进行除磷.
①投放的镁盐让磷酸根形成Mg3(PO4)2沉淀而除磷.如图1显示,沉淀过程的 pH 对废水中磷的去除率影响很大.从如图可知,最佳除磷的pH范围是
②若处理后的废水中c(Mg2+)=1.0×10-6mol/L时,试计算溶液中的c(PO43-)(写出计算过程,已知Ksp[Mg3(PO4)2]=1.0×10-24)
③若废水中还含有大量的NH4+,投放镁盐,可得到磷酸氨镁晶体(MgNH4PO4?6H2O),可用作化肥.写出该反应的离子方程式
④实验表明,其他条件相同时学科王,温度越高,残余磷浓度越高.已知30℃时,c(PO43-)~反应时间t的变化曲线如图2.若保持其他条件不变,请在坐标图中,画出60℃时c(PO43-)~反应时间t的变化曲线示意图.
考点:热化学方程式,难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:(1)据盖斯定律,将所给的三个反应:①×2+②可得总反应以及△H.
(2)①根据图可知,去除率较大时所对应的PH值即是;根据 Mg2+与OH-反应生成更难溶的Mg(OH)2;
②根据Ksp[Mg3(PO4)2]=1.0×10-24计算;
③根据题目信息书写方程式,注意电荷守恒;
④根据温度越高,反应速率增大,残余磷浓度越高,画出60℃时c(PO43-)~反应时间t的变化曲线示意图;
(2)①根据图可知,去除率较大时所对应的PH值即是;根据 Mg2+与OH-反应生成更难溶的Mg(OH)2;
②根据Ksp[Mg3(PO4)2]=1.0×10-24计算;
③根据题目信息书写方程式,注意电荷守恒;
④根据温度越高,反应速率增大,残余磷浓度越高,画出60℃时c(PO43-)~反应时间t的变化曲线示意图;
解答:
解:(1)将所给的三个反应:①×2+②可得总反应以及△H,2CN-(aq)+5O3(g)+H2O(l)═N2(g)+2HCO
(aq)+5O2(g) 2△H1+△H2
故答案为:2CN-(aq)+5O3(g)+H2O(l)═N2(g)+2HCO
(aq)+5O2(g);2△H1+△H2;
(2)①从如图可知,pH在10~11为除磷的最佳范围;当pH较高时,磷去除率下降的原因是Mg2+与OH-反应生成更难溶的Mg(OH)2;
故答案为:10~11; Mg2+与OH-反应生成更难溶的Mg(OH)2;
②Ksp[Ca3(PO4)2]=c3(Mg2+)×c2(PO
)=1.0×10-24,即1.0×10-18×c2(PO43-)=1.0×10-24,c(PO43-)=1.0×10-3mol?L-1;
故答案为:1.0×10-3mol?L-1;
③废水中还含有大量的NH4+,投放镁盐,可得到磷酸氨镁晶体(MgNH4PO4?6H2O),方程式为:Mg2++NH4++PO43-+6H2O═MgNH4PO4?6H2O↓;
古答案为:Mg2++NH4++PO43-+6H2O═MgNH4PO4?6H2O↓;
④温度越高,反应速率增大,残余磷浓度越高,则60℃时c(PO43-)~反应时间t的变化曲线示意图为 ;
;
故答案为: ;
;
- 3 |
故答案为:2CN-(aq)+5O3(g)+H2O(l)═N2(g)+2HCO
- 3 |
(2)①从如图可知,pH在10~11为除磷的最佳范围;当pH较高时,磷去除率下降的原因是Mg2+与OH-反应生成更难溶的Mg(OH)2;
故答案为:10~11; Mg2+与OH-反应生成更难溶的Mg(OH)2;
②Ksp[Ca3(PO4)2]=c3(Mg2+)×c2(PO
3- 4 |
故答案为:1.0×10-3mol?L-1;
③废水中还含有大量的NH4+,投放镁盐,可得到磷酸氨镁晶体(MgNH4PO4?6H2O),方程式为:Mg2++NH4++PO43-+6H2O═MgNH4PO4?6H2O↓;
古答案为:Mg2++NH4++PO43-+6H2O═MgNH4PO4?6H2O↓;
④温度越高,反应速率增大,残余磷浓度越高,则60℃时c(PO43-)~反应时间t的变化曲线示意图为
 ;
;故答案为:
 ;
;
点评:本题考查了盖斯定律的运用,溶度积的计算、离子方程式的书写,探究温度对反应速率的影响,题目难度中等,试题侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
实验室将NaClO3和Na2SO3按物质的量之比2:1倒入烧瓶中,用水浴加热,同时滴入H2SO4,产生棕黄色气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为( )
| A、Cl2 |
| B、Cl2O |
| C、ClO2 |
| D、Cl2O3 |
 由可逆反应测绘出的图象如图所示,纵坐标为生成物在平衡体系中的百分含量,下列对该反应判断正确的是( )
由可逆反应测绘出的图象如图所示,纵坐标为生成物在平衡体系中的百分含量,下列对该反应判断正确的是( )| A、反应物中一定有气体 |
| B、生成物中一定无气体 |
| C、正反应一定是放热反应 |
| D、正反应一定是吸热反应 |
下列关于实验操作的陈述中正确的是( )
| A、用规格为20mL的量筒一次量取16mL溶液,比用规格为10mL的量筒分两次量取16mL溶液的误差小 |
| B、受热后的蒸发皿要用坩锅钳夹取,并放在石棉网上冷却 |
| C、过滤时,为了加速溶液透过滤纸,可以用玻璃棒末端轻轻搅拌滤纸上的混合物 |
| D、配制一定物质的量浓度溶液时,为了避免溶质的损失,直接把称量的固体溶质转移到容量瓶中 |