题目内容
硫化物通常有“废物”之称.硫化物据其溶解性可以分三类:①易溶于水的有 K2S、Na2S、(NH4)2S 等; ②易溶于非氧化性强酸、不溶于水的有 FeS、ZnS; ③大部分的硫化物既不溶于水也不溶于非氧化性强酸,如 HgS、Ag2S、CuS、Cu2S.其中,Ag2S、CuS、Cu2S 能溶于硝酸发生氧化还原反应,而 HgS只能溶于王水(硝酸与盐酸的混合液).氢硫酸溶液中存在下列平衡:
H2S?H ++HS-,HS-?H ++S2-.
(1)K2S溶液显 性,原因 (用离子方程式表示),K2S溶液中离子浓度由大到小顺序 ;
(2)推测将硫化氢通入硫酸铜溶液中生成硫酸的原因是 ;
(3)在氢硫酸溶液中改变下列条件,使溶液中.c(OH-)、c(S2-)都增大的是
A.加入少量的漂白粉 B.通入氨气
C.加入少量过氧化钠粉末 D.加入少量硝酸银溶液
(4)已知在常温下 FeS 的Ksp=6.25×10-18,H2S饱和溶液中c(H+)与c S2-)之间存在如下关系:c2(H+)?(S2-)=1.0×10-22.在该温度下,将适量FeS 入硫化氢饱和溶液中,欲使溶液中(Fe2+)为 lmol/L,应调节溶液的c(H十)为 .
H2S?H ++HS-,HS-?H ++S2-.
(1)K2S溶液显
(2)推测将硫化氢通入硫酸铜溶液中生成硫酸的原因是
(3)在氢硫酸溶液中改变下列条件,使溶液中.c(OH-)、c(S2-)都增大的是
A.加入少量的漂白粉 B.通入氨气
C.加入少量过氧化钠粉末 D.加入少量硝酸银溶液
(4)已知在常温下 FeS 的Ksp=6.25×10-18,H2S饱和溶液中c(H+)与c S2-)之间存在如下关系:c2(H+)?(S2-)=1.0×10-22.在该温度下,将适量FeS 入硫化氢饱和溶液中,欲使溶液中(Fe2+)为 lmol/L,应调节溶液的c(H十)为
考点:盐类水解的原理,弱电解质在水溶液中的电离平衡,难溶电解质的溶解平衡及沉淀转化的本质,离子浓度大小的比较
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:(1)硫化钾为强碱弱酸盐,硫离子水解而使其溶液呈碱性;硫离子水解分两步进行,第一步水解程度远远大于第二步,但水解程度都较小;
(2)硫化氢通入硫酸铜溶液中会发生复分解反应;
(3)H2S溶液中存在H2S?HS-+H+,HS-?S2-+H+,采取措施使c(OH-)、c(S2-)都增大,根据平衡移动的影响因素来回答,以此解答该题;
(4)根据硫化亚铁的溶度积常数和亚铁离子浓度计算硫离子浓度,再根据氢硫酸的电离平衡常数计算氢离子浓度,最后利用pH计算公式计算溶液的pH.
(2)硫化氢通入硫酸铜溶液中会发生复分解反应;
(3)H2S溶液中存在H2S?HS-+H+,HS-?S2-+H+,采取措施使c(OH-)、c(S2-)都增大,根据平衡移动的影响因素来回答,以此解答该题;
(4)根据硫化亚铁的溶度积常数和亚铁离子浓度计算硫离子浓度,再根据氢硫酸的电离平衡常数计算氢离子浓度,最后利用pH计算公式计算溶液的pH.
解答:
解:(1)硫化钾为强碱弱酸盐,硫离子水解而使其溶液呈碱性,其水解离子方程式为S2-+H2O?HS-+OH-、HS-+H2O?H2S-+OH-;硫离子水解分两步进行,第一步水解程度远远大于第二步,但水解程度都较小,硫氢根离子和硫离子水解都生成氢氧根离子,只有硫离子水解生成硫氢根离子,溶液呈碱性,则溶液中离子浓度 大小顺序是C(K+)>C(S2-)>C(OH-)>C(HS-)>C(H+),
故答案为:碱;S2-+H2O?HS-+OH-、HS-+H2O?H2S-+OH-;C(K+)>C(S2-)>C(OH-)>C(HS-)>C(H+);
(2)硫化氢通入硫酸铜溶液中会发生复分解反应:H2S+CuSO4=CuS↓+H2SO4,故答案为:H2S+CuSO4=CuS↓+H2SO4;
(3)H2S溶液中存在H2S?HS-+H+,HS-?S2-+H+,
A.加入少量的漂白粉,属于碱性物质,则平衡右移,c(OH-)、c(S2-)都增大,故A正确;
B.通入氨气,则平衡右移,c(OH-)、c(S2-)都增大,故B正确;
C.加入少量过氧化钠粉末,能将硫离子氧化,硫离子浓度减小,故C错误;
D.加入少量硝酸银溶液,会消耗硫离子,硫离子浓度减小,故D错误.
故选AB;
(4)溶液中c(S2-)=
=6.25×10-18mol/L,c2(H+)?c(S2-)=1.0×10-22,则c(H+)=
mol/L=4×10-3mol/L,pH=-lg4×10-3=2.4,
故答案为:2.4.
故答案为:碱;S2-+H2O?HS-+OH-、HS-+H2O?H2S-+OH-;C(K+)>C(S2-)>C(OH-)>C(HS-)>C(H+);
(2)硫化氢通入硫酸铜溶液中会发生复分解反应:H2S+CuSO4=CuS↓+H2SO4,故答案为:H2S+CuSO4=CuS↓+H2SO4;
(3)H2S溶液中存在H2S?HS-+H+,HS-?S2-+H+,
A.加入少量的漂白粉,属于碱性物质,则平衡右移,c(OH-)、c(S2-)都增大,故A正确;
B.通入氨气,则平衡右移,c(OH-)、c(S2-)都增大,故B正确;
C.加入少量过氧化钠粉末,能将硫离子氧化,硫离子浓度减小,故C错误;
D.加入少量硝酸银溶液,会消耗硫离子,硫离子浓度减小,故D错误.
故选AB;
(4)溶液中c(S2-)=
| Ksp |
| c(Fe2+) |
|
故答案为:2.4.
点评:本题考查了离子浓度大小的比较、溶度积程度的有关计算,根据盐的性质结合盐类水解来确定离子浓度大小,根据溶度积常数及弱酸的电离平衡常数计算溶液的pH,题目难度中等.

练习册系列答案
相关题目
抗生素能抑制或杀灭细菌、霉菌、支原体、衣原体等微生物,它的使用帮助人类战胜了多种疾病.关于抗生素的使用,下列说法正确的是( )
| A、当周围有人感染埃博拉病毒(EBOV)时,可以吃些抗生素以防被传染 |
| B、上呼吸道感染、咽痛等病毒疾病应该使用抗生素治疗 |
| C、抗生素在治病的同时也有副作用,没有一种抗生素是绝对安全而无副作用的 |
| D、使用某抗生素一两天后病情没有明显好转,应尽快换用其他抗生素 |
已知酸性: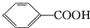 >H2C03>
>H2C03>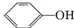 ,将
,将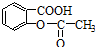 转变为
转变为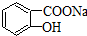 的方法有( )
的方法有( )
①与足量的NaOH溶液共热,再通入CO2
②与稀硫酸共热后,加入足量的NaOH溶液
③与稀H2SO4共热后,加入足量的NaHCO3.
 >H2C03>
>H2C03> ,将
,将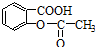 转变为
转变为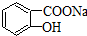 的方法有( )
的方法有( )①与足量的NaOH溶液共热,再通入CO2
②与稀硫酸共热后,加入足量的NaOH溶液
③与稀H2SO4共热后,加入足量的NaHCO3.
| A、①② | B、①③ | C、②③ | D、① |
某溶液中可能含有Na+、Al3+、Ba2+、SO42-、I-、S2-中的几种.分别取样进行以下实验:
①用pH计测试,溶液显弱酸性;②加新制氯水和淀粉溶液无明显现象.为确定该溶液的组成,还需检验的离子是( )
①用pH计测试,溶液显弱酸性;②加新制氯水和淀粉溶液无明显现象.为确定该溶液的组成,还需检验的离子是( )
| A、Na+ |
| B、SO42-,Na+ |
| C、S2-,SO42-,Na+ |
| D、Al3+ |
下列有关物质制备的说法中正确的是( )
| A、工业上通过电解MgO制取镁 |
| B、工业上通过向浓缩的海水中通入氯气获得碘 |
| C、工业上主要通过高温冶炼黄铜矿获得铜 |
| D、工业上用二氧化锰与浓盐酸制备氯气 |
对于反应2SO2(g)+O2(g)═2SO3(g)△H<0,能增大正反应速率且提高O2的转化率的措施是( )
| A、移去部分SO3 |
| B、降低体系温度 |
| C、压缩反应容器的体积 |
| D、升高体系温度 |
下列说法正确的是( )
| A、HF、HCl、HBr、HI的热稳定性依次减弱,沸点却依次升高 |
| B、熔融状态下能导电的化合物一定含离子键;金属与非金属元素形成的化合物一定是离子化合物 |
| C、NaHSO4晶体中阴、阳离子的个数是1:2且熔化时破坏的是离子键和共价键 |
| D、NCl3分子中所有的原子均为8电子稳定结构 |