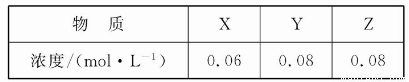
题目内容
如图是某硫酸试剂瓶标签上的部分文字。据此,下列说法正确的是( )
硫酸 化学纯(CP)(500 mL) 品名:硫酸 化学式:H2SO4 相对分子质量:98 密度:1.84 g/cm3 质量分数:98% |
A.该硫酸的物质的量浓度为9.2 mol/L
B.1 mol Zn与足量的该硫酸反应生成2 g氢气
C.该硫酸与等体积水混合所得溶液的物质的量浓度等于9.2 mol/L
D.向50 mL该硫酸溶液中加入足量的铜片,加热充分反应后,被还原的硫酸的物质的量小于0.46 mol
D
【解析】由c= =
= =18.4 mol/L,A错误;浓硫酸具有强氧化性,其还原产物为SO2,B错误;该硫酸与等体积的水混合,溶质的物质的量不变,但体积比原H2SO4体积的2倍要小,故所得混合液的物质的量浓度大于9.2 mol/L,C错误;D中随反应进行,浓硫酸变为稀硫酸时反应停止,被还原的硫酸小于
=18.4 mol/L,A错误;浓硫酸具有强氧化性,其还原产物为SO2,B错误;该硫酸与等体积的水混合,溶质的物质的量不变,但体积比原H2SO4体积的2倍要小,故所得混合液的物质的量浓度大于9.2 mol/L,C错误;D中随反应进行,浓硫酸变为稀硫酸时反应停止,被还原的硫酸小于 ×0.05 L×18.4 mol/L,即小于0. 46 mol。
×0.05 L×18.4 mol/L,即小于0. 46 mol。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案铁在冷的浓硫酸中能发生钝化。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。实验室现有下列试剂:0.01 mol/L 酸性KMnO4溶液、0.1 mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分。
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有_________中的一种或两种。
| 实验操作 | 预期现象 | 结论 |
验证猜想Ⅰ | 步骤①:取少量0.01 mol/L酸性KMnO4溶液,滴入所得溶液 |
|
|
步骤②:_________ |
| 含有Fe3+ | |
验证猜想Ⅱ | 将所得气体通入如下装置 |
| 含有两种气体 |
【实验探究】

【问题讨论】
有同学提出,若另外选用KSCN溶液,则仅利用KSCN和H2O2两种溶液即可完成猜想Ⅰ的所有探究,判断该方法是否正确并进行评价:_________。