题目内容
19.由碳棒、铁片和200mL1.5mol•L-1的稀硫酸组成的原电池中,当在碳棒上产生气体3.36L(标准状况)时,求:有1.806×1023个电子过了电线?(NA=6.02×1023)分析 碳棒、铁片和稀硫酸组成的原电池,总反应式为Fe+H2SO4=FeSO4+H2↑,根据氢气与电子的关系式计算.
解答 解:碳棒、铁片和稀硫酸组成的原电池,总反应式为Fe+H2SO4=FeSO4+H2↑,碳棒为正极,电极反应式为:2H++2e-=H2↑,设转移电子x,则氢气与电子的关系为:
H2~~~~~2e-
22.4L 2NA
3.36L x
x=$\frac{3.36×2{N}_{A}}{22.4}$=1.806×1023,
答:当在碳棒上产生气体3.36L(标准状况)时,有1.806×1023个电子通过了电线.
点评 本题以原电池为载体考查了氧化还原反应的有关计算,明确各物理量间的关系是解本题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.下列说法正确的是( )
| A. | 碳酸钠可作为治疗胃溃疡病人的胃酸过多症的药物 | |
| B. | 为了提高铜粉与硝酸的反应速率,可向烧瓶中加入少量石墨或硝酸银浓溶液 | |
| C. | 向柠檬醛 中加入高锰酸钾性溶液,溶液褪色,说明柠檬醛分子中含有醛基 中加入高锰酸钾性溶液,溶液褪色,说明柠檬醛分子中含有醛基 | |
| D. |  名称为:1,3─二甲基─2─丁烯 名称为:1,3─二甲基─2─丁烯 |
10.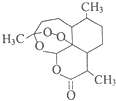 青蒿素(结构简式如图)是一种白色针状固体,曾被世界卫生组织称做是“世界上唯一有效的疟疾治疗药物”.中国女科学家屠呦呦凭借用乙醚从青蒿中提取青蒿素获得2015年诺贝尔医学奖.下列关于青蒿素的说法不正确的是( )
青蒿素(结构简式如图)是一种白色针状固体,曾被世界卫生组织称做是“世界上唯一有效的疟疾治疗药物”.中国女科学家屠呦呦凭借用乙醚从青蒿中提取青蒿素获得2015年诺贝尔医学奖.下列关于青蒿素的说法不正确的是( )
 青蒿素(结构简式如图)是一种白色针状固体,曾被世界卫生组织称做是“世界上唯一有效的疟疾治疗药物”.中国女科学家屠呦呦凭借用乙醚从青蒿中提取青蒿素获得2015年诺贝尔医学奖.下列关于青蒿素的说法不正确的是( )
青蒿素(结构简式如图)是一种白色针状固体,曾被世界卫生组织称做是“世界上唯一有效的疟疾治疗药物”.中国女科学家屠呦呦凭借用乙醚从青蒿中提取青蒿素获得2015年诺贝尔医学奖.下列关于青蒿素的说法不正确的是( )| A. | 青蒿素分子中含有醚键和酯基等官能团 | |
| B. | 青蒿素在加热时能与NaOH的水溶液反应 | |
| C. | 青蒿素易溶于水、苯等溶剂 | |
| D. | 用乙醚从青蒿中提取青蒿素,用到了萃取原理 |
7.下列关于燃料的说法错误的是( )
| A. | 燃料燃烧产物CO2是温室气体之一 | |
| B. | 化石燃料完全燃烧不会造成大气污染 | |
| C. | 以液化石油气代替燃油可减少大气污染 | |
| D. | 燃料不完全燃烧排放的CO是大气污染物之一 |
14.化学与生活密切相关,下列有关说法错误的是( )
| A. | 用灼烧的方法可以区分蚕丝和人造纤维 | |
| B. | 食用油反复加热会产生稠环芳香烃等有害物质 | |
| C. | 加热能杀死流感病毒是因为蛋白质受热变性 | |
| D. | 医用消毒酒精中乙醇的浓度为95% |
11.下列关于离子共存或离子反应的说法正确的是( )
| A. | 某无色溶液中可能大量存在H+、Cl-、MnO4- | |
| B. | pH=2的溶液中可能大量存在Na+、NH4+、SiO32- | |
| C. | Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2 O2+2H+═2Fe3++2H2O | |
| D. | 稀硫酸与Ba(OH)2溶液的反应:H++SO42-+Ba2++OH-═BaSO4↓+2H2O |
13.氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2.某同学在实验室中对NH3与NO2反应进行了探究.回答下列问题:
(1)氨气的制备
①氨气的发生装置可以选择上图中的A,反应的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→d→c→f→e→j(按气流方向,用小写字母表示).
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好).在一定温度下按图示装置进行实验.

(1)氨气的制备

①氨气的发生装置可以选择上图中的A,反应的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→d→c→f→e→j(按气流方向,用小写字母表示).
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好).在一定温度下按图示装置进行实验.

| 操作步骤 | 实验现象 | 解释原因 |
| 打开K1,推动注射器活塞,使X中的气体缓慢充入Y管中 | ①Y管中红棕色气体慢慢变浅 | ②反应的化学方程式 8NH3+6NO2$\frac{\underline{\;催化剂\;}}{\;}$7N2+12H2O |
| 将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝聚 |
| 打开K2 | ③Z中NaOH溶液产生倒吸现象 | ④反应后气体分子数减少,Y管压强小于外压 |
2.下列有关500mL0.2mol•L-1氨水的叙述,正确的是( )
| A. | 含有0.1molNH3•H2O | |
| B. | 溶液中NH3的物质的量浓度为0.2mol•L-1 | |
| C. | NH3和NH3•H2O的物质的量浓度之和为0.2mol•L-1 | |
| D. | NH3、NH3•H2O和NH4+的物质的量之和为0.1mol |
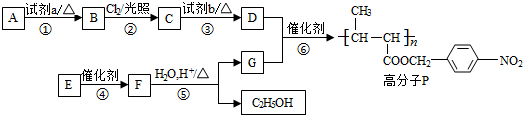
 .
. +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$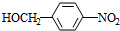 +NaCl.
+NaCl.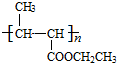 +nH2O$→_{△}^{H+}$
+nH2O$→_{△}^{H+}$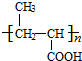 +n CH3CH2OH.
+n CH3CH2OH.