题目内容
8.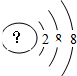 某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.
某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.(1)该微粒是中性微粒,这种微粒的符号是Ar.
(2)该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,这种微粒的符号是Cl-.
分析 (1)该微粒是中性微粒,质子数10,为Ne原子;
(2)该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,则原子质子数为2+8-1=9,为F-离子,其单质氟气与水反应生成HF与氧气;
解答 解:(1)该微粒是中性微粒,则核内有18个质子,即为18号元素氩,即为Ar原子,故答案为:Ar;
(2)该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,则原子质子数为2+8+8-1=17,为Cl-离子,故答案为:Cl-;
点评 本题考查较为综合,为高频考点,依托微粒的结构示意图考查了微粒的种类,要注意阴离子:质子数=核外电子数-电荷数,阳离子=核外电子数+电荷数,难度不大.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
2.常温下,下列溶液中各组离子一定能够大量共存的是( )
| A. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- | |
| B. | 水电离的c(H+)=10-12 mol•L-1的溶液:K+、Ba2+、NH4+、Br- | |
| C. | $\frac{{K}_{w}}{c({H}^{+})}$=0.1 mol•L-1的溶液:Na+、K+、SiO32-、NO3- | |
| D. | 1.0 mol•L-1的CaCl2溶液:Na+、K+、Cl-、CO32- |
3. 仅用下表右边的装置和表中提供的相应容器中的物质完成相关实验,最合理的选项是( )
仅用下表右边的装置和表中提供的相应容器中的物质完成相关实验,最合理的选项是( )
 仅用下表右边的装置和表中提供的相应容器中的物质完成相关实验,最合理的选项是( )
仅用下表右边的装置和表中提供的相应容器中的物质完成相关实验,最合理的选项是( )| 选项 | ① | ② | ③ | 实验目的或结论 |
| A | 浓氨水 | 生石灰 | 水 | 制取氨气并吸收尾气 |
| B | 浓盐酸 | 二氧化锰 | 淀粉碘化钾溶液 | 氧化性:MnO2>Cl2>I2 |
| C | 浓磷酸 | 氢溴酸溶液 | AgCl的浊液 | 验证Ksp(AgCl)>Ksp(AgBr) |
| D | 浓硫酸 | 亚硫酸钠 | 高锰酸钾溶液 | 验证二氧化硫的漂白性 |
| A. | A | B. | B | C. | C | D. | D |
20.下列有关化学用语的表示或说法正确的是( )
| A. | H3O+的电子式为 | |
| B. | -NH2的电子式为 | |
| C. | NaHS显碱性的原因是HS-+H2O?S2-+H3O+ | |
| D. | 乙烷的二氯代物有两种(不考虑立体异构) |
3.粗盐提纯制精盐的实验中,不需要的操作是( )
| A. | 溶解 | B. | 过滤 | C. | 洗涤 | D. | 蒸馏 |
13.下列物质的电子式书写正确的是( )


| A. | ①②③④ | B. | ⑤⑥⑦⑧ | C. | ②③⑤⑥⑦ | D. | ①④⑧ |
18.下列关于原子结构、元素性质的说法正确的是( )
| A. | 非金属元素组成的化合物中只含共价键 | |
| B. | ⅠA族金属元素是同周期中金属性最强的元素 | |
| C. | 同种元素的原子均有相同的质子数和中子数 | |
| D. | 稀有气体原子的最外层电子数都是8 |
 ;
;