题目内容
17.亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业.它在碱性环境中稳定存在.某同学查阅资料后设计生产NaClO2的主要流程如下.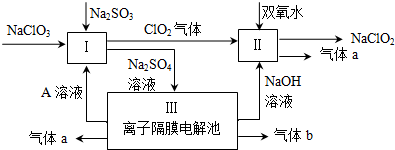
(1)Ⅰ、Ⅲ中发生反应的还原剂分别是Na2SO3、H2O(填化学式).
(2)Ⅱ中反应的离子方程式是2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O
(3)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:
5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O.
①该反应中氧化剂和还原剂的物质的量之比是1:4
②研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析其原因是ClO2-的氧化性或Cl-的还原性随溶液的酸性和浓度的增大而增强,因此Cl-被氧化得到Cl2
分析 硫酸钠溶液通入离子隔膜电解池中,ClO2和双氧水在II中发生氧化还原反应生成NaClO2和气体a,该反应中Cl元素化合价由+4价变为+3价,则O元素化合价由-1价变为0价,所以生成的气体a是O2,离子反应方程式为2 ClO2+H2O2+2OH-=2 ClO2-+O2↑+2H2O;
III中发生电解,根据图知,生成氢氧化钠,阴极上生成氢气同时阴极附近生成NaOH,所以生成的气体b是H2;阳极上氢氧根离子放电生成氧气,所以a是O2,同时生成硫酸,所以A溶液是硫酸;酸性条件下,I中NaClO2、Na2SO3发生氧化还原反应,离子反应方程式为2ClO3-+2H++SO32-=2ClO2↑+SO42-+H2O;
(1)同一化学反应中,失电子化合价降低的反应物是还原剂;
(2)碱性条件下,ClO2、H2O2发生氧化还原反应生成氧气、ClO2-和水;
(3)①根据在反应物中,化合价降低的物质是氧化剂,化合价升高的物质是还原剂来分析解答;
②根据题干信息“研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大”结合①方程式进行分析解答.
解答 解:硫酸钠溶液通入离子隔膜电解池中,ClO2和双氧水在II中发生氧化还原反应生成NaClO2和气体a,该反应中Cl元素化合价由+4价变为+3价,则O元素化合价由-1价变为0价,所以生成的气体a是O2,离子反应方程式为2 ClO2+H2O2+2OH-=2 ClO2-+O2↑+2H2O;
III中发生电解,根据图知,生成氢氧化钠,阴极上生成氢气同时阴极附近生成NaOH,所以生成的气体b是H2;阳极上氢氧根离子放电生成氧气,所以a是O2,同时生成硫酸,所以A溶液是硫酸;酸性条件下,I中NaClO2、Na2SO3发生氧化还原反应,离子反应方程式为2ClO3-+2H++SO32-=2ClO2↑+SO42-+H2O;
(1)同一化学反应中,失电子化合价降低的反应物是还原剂,
I中反应方程式为2ClO3-+2H++SO32-=2ClO2↑+SO42-+H2O,还原剂是Na2SO3;III中氧化剂和还原剂都是水,
故答案为:Na2SO3;H2O;
(2)碱性条件下,ClO2、H2O2发生氧化还原反应生成氧气、ClO2-和水,离子方程式为2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O,
故答案为:2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O;
(3)①5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O反应中,4NaClO2→4ClO2,+3价的氯元素化合价升高到+4价,所以NaClO2是还原剂;1NaClO2→1NaCl,+3价的氯元素的化合价降低到-1价,所以部分NaClO2作氧化剂;所以该反应中氧化剂和还原剂的物质的量之比为1:4,
故答案为:1:4;
②5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O反应中,ClO2-具有氧化性,ClO2-的氧化性随溶液的酸性和浓度的增大而增强,因此Cl-被氧化得到Cl2,根据研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,
故答案为:ClO2-的氧化性或Cl-的还原性随溶液的酸性和浓度的增大而增强,因此Cl-被氧化得到Cl2.
点评 本题考查生产NaClO2的制备实验的工业设计,把握物质的性质熟练运用氧化还原反应为解答该题的关键,题目难度中等.

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案| A. | 铝片不用特殊方法保护 | |
| B. | 轮船水线下的船体上装一定数量的锌块 | |
| C. | 纯锌与稀硫酸反应时,滴入少量CuSO4溶液后速率增大 | |
| D. | 镀锌铁比较耐用 |
| X | Y | |
| Z | D |
(2)X、D的氢化物相遇时产生的现象是冒白烟.
(3)X的最高价氧化物的水化物M,其稀溶液能与Z的低价氧化物反应,离子方程式为2NO3-+3SO2+2H2O═4H++2NO↑+3SO42-,则M的稀溶液的氧化性大于Z的最高价氧化物的水化物的稀溶液的氧化性(填“大于”、“等于”或“小于”).
(4)E的某种氧化物能与水发生氧化还原反应,离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑.0.1mol E的该氧化物完全反应,转移电子数目为0.1NA.
| A. | Ds原子在周期表中位于第7周期第Ⅷ族 | |
| B. | Ds是IB元素 | |
| C. | Ds元素为放射性元素 | |
| D. | Ds元素在元素周期表中d区 |
| A. | 1 mol NH4CI 固体中共价键总数为5NA | |
| B. | 16g O2与O3的混合物中含有NA个氧原子 | |
| C. | 向装有催化剂的密闭容器加入3molH2和1 mol N2,充分反应后得2NA 个氨分子 | |
| D. | 18g水(H2O)含有8NA个中子 |
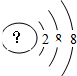 某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.
某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.