题目内容
15.单原子离子R2-含有18个电子,则元素R在周期表的位置是( )| A. | 第三周期0族 | B. | 第二周期ⅥA族 | C. | 第三周期ⅡA族 | D. | 第三周期ⅥA族 |
分析 根据阴离子中:电子数=质子数+电荷数,进行分析解答.
解答 解:阴离子R2-中含有18个电子,则R原子的核外电子数是16,原子中质子数等于核外电子数,故该原子的质子数是16,即为S元素,在周期表中位于第三周期ⅥA族;
故选:D.
点评 本题考查了阴离子中微粒数之间的关系和元素的推断,题目难度不大,灵活运用微粒中质子数与核外电子数的关系是正确解答本题的关键.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
6.实验室检验硫酸亚铁溶液是否变质,选择的试剂是( )
| A. | HCl | B. | AgN03 | C. | KSCN | D. | KCN |
10.两种烃的衍生物A和B,所含碳、氢、氧的质量比均为6:1:4.完全燃烧0.1mol A能生成3.6g水.B只含一个醛基,1.1g B与足量银氨溶液反应,可析出2.7g Ag.则下列关于物质A和物质B的判断正确的是( )
| A. | 物质A一定是乙醛 | |
| B. | 物质B的分子式为C4H8O2 | |
| C. | 物质B的同分异构体中既含有醛基又含有羟基的共有6种 | |
| D. | 物质A和物质B互为同分异构体 |
7.下列说法错误的是( )
| A. | 安装燃煤“固硫”装置,可以降低酸雨发生率 | |
| B. | 氮的固定只有在高温、高压、催化剂的条件下才能实现 | |
| C. | 研发易降解塑料,防止白色污染 | |
| D. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 |
4.短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、Z原子的最外层电子数之和为12,Y、Z、W位于同一周期,Z原子的最外层电子数既是X原子内层电子总数的3倍,又是Y原子最外层电子数的3倍.下列说法正确的是( )
| A. | 原子半径:Y>X,离子半径:Z<W | |
| B. | 元素Y的单质能与元素X的最高价氧化物发生置换反应 | |
| C. | 元素Y和W能形成YW2型共价化合物 | |
| D. | W的单质有毒,且有漂白性 |
5.研究化学反应常用${\;}_8^{18}$O作为示踪原子,该原子的质子数是( )
| A. | 18 | B. | 8 | C. | 10 | D. | 16 |
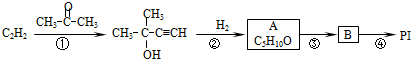
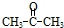 ”改为“乙醛”,经过②③④后得到产物的结构简式是
”改为“乙醛”,经过②③④后得到产物的结构简式是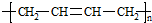 .
.

 +n NaOH→
+n NaOH→ +n CH3COONa.
+n CH3COONa.