题目内容
1.下列各物质中,互为同系物的是( )| A. | 丁烷和2,2-二甲基丙烷 | B. |  和 和 | ||
| C. | CH2=CH-CH=CH2和CH3-CH2-C≡CH | D. |  和 和 |
分析 结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物;互为同系物的物质满足以下特点:结构相似、化学性质相似、分子式通式相同、分子式不同、物理性质不同,研究对象是有机物.
解答 解:A.丁烷和2,2-二甲基丙烷都是烷烃,二者结构相似、分子间相差1个CH2原子团,所以二者互为同系物,故A正确;
B. 和
和 二者分子式不相同,含有官能团个数不相同,所以二者不是同系物,故B错误;
二者分子式不相同,含有官能团个数不相同,所以二者不是同系物,故B错误;
C.CH2=CH-CH=CH2和CH3-CH2-C≡CH,二者分子式相同,含有官能团分别为双键和三键,不是同系物,故C错误;
D. 和
和 ,二者分子式不同,结构不同,后者除含有苯环外,还含有出错双键,所以不是同系物,故D错误;
,二者分子式不同,结构不同,后者除含有苯环外,还含有出错双键,所以不是同系物,故D错误;
故选A.
点评 本题考查了同系物的判断,题目难度中等,明确满足同系物的有机物,若含有官能团,则含有的官能团类型和数目必须完全相同.

练习册系列答案
 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
2.下列关于甲苯的实验中,能说明苯环对侧链有影响的是( )
| A. | 甲苯硝化生成三硝基甲苯 | B. | 甲苯能使酸性高锰酸钾溶液褪色 | ||
| C. | 甲苯燃烧带有浓厚的黑烟 | D. | 甲苯与氢气可以生加成反应 |
3.A、B、C、D、E均为氯的含氧化合物,我们不了解它们的分子式(或化学式),但知道它们在一定条件下具有如下的转化关系(未配平):
①B+H2O $\stackrel{电解}{→}$ C+H2↑ ②A→B+NaCl ③E+NaOH→B+C+H2O ④D+NaOH→A+B+H2O
这五种化合物中含氯的化合价由高到低的顺序为( )
①B+H2O $\stackrel{电解}{→}$ C+H2↑ ②A→B+NaCl ③E+NaOH→B+C+H2O ④D+NaOH→A+B+H2O
这五种化合物中含氯的化合价由高到低的顺序为( )
| A. | C、B、E、D、A | B. | B、D、A、C、E | C. | C、D、E、A、B | D. | C、E、B、D、A |
9.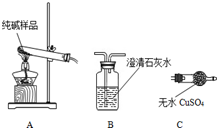 某实验小组模拟“侯氏制碱法”制纯碱,并进行以下探究:
某实验小组模拟“侯氏制碱法”制纯碱,并进行以下探究:
(1)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:
(2)测定该纯碱样品的纯度:称取m1g样品,置于小烧杯中,加水溶解,滴加足量CaCl2溶液.将反应混和物过滤、洗涤(填操作)、干燥、称量为m2g.该纯碱样品的纯度为$\frac{106{m}_{2}}{{m}_{1}}$%.
(3)该小组同学在0.1mol/LNaHCO3溶液中滴加酚酞溶液1滴,溶液没有什么变化,但加热后显淡红色,加热较长时间后冷却,红色不褪去.为探究原因,进行了下列实验:
实验1:加热0.1mol/LNaHCO3溶液,测得溶液pH变化如下表
但当温度恢复到10℃,测得溶液pH=9.8.
实验2:加热0.1mol/LNaHCO3溶液,将产生的气体通入澄清石灰水,澄清石灰水变浑浊.
①用离子方程式表示0.1mol/LNaHCO3溶液中存在的平衡(除水电离平衡外)HCO3-?H++CO32-、HCO3-+H2O?H2CO3+OH-.这两个平衡以水解平衡为主.
②结合实验1、2分析,加热0.1mol/LNaHCO3溶液,pH增大的原因可能是NaHCO3分解生成Na2CO3,碱性增强(答一条).
 某实验小组模拟“侯氏制碱法”制纯碱,并进行以下探究:
某实验小组模拟“侯氏制碱法”制纯碱,并进行以下探究:(1)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:
| 选择的装置 (填编号) | 实验现象 | 实验结论 |
| AB或AC或ACB | B变浑浊或C变蓝或C变蓝、B变浑 | 样品含 NaHCO3 |
(3)该小组同学在0.1mol/LNaHCO3溶液中滴加酚酞溶液1滴,溶液没有什么变化,但加热后显淡红色,加热较长时间后冷却,红色不褪去.为探究原因,进行了下列实验:
实验1:加热0.1mol/LNaHCO3溶液,测得溶液pH变化如下表
| 温度(℃) | 10 | 20 | 30 | 50 | 70 | 80 | 100 |
| pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 | 9.6 | 10.1 |
实验2:加热0.1mol/LNaHCO3溶液,将产生的气体通入澄清石灰水,澄清石灰水变浑浊.
①用离子方程式表示0.1mol/LNaHCO3溶液中存在的平衡(除水电离平衡外)HCO3-?H++CO32-、HCO3-+H2O?H2CO3+OH-.这两个平衡以水解平衡为主.
②结合实验1、2分析,加热0.1mol/LNaHCO3溶液,pH增大的原因可能是NaHCO3分解生成Na2CO3,碱性增强(答一条).
16.工业上设计将VOSO4、SO2杂质除去并回收得到V2O5的流程如下:
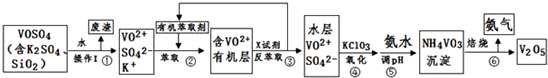
请回答下列问题:
(1)步骤①所得废渣的成分是SiO2(写化学式),操作Ⅰ的名称过滤.
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层)
②中萃取时必须加入适量碱,其原因是加入碱中和硫酸,促使平衡正向移动,提高钒的萃取率.
③中X试剂为H2SO4.
(3)④的离子方程式为ClO3-+6VO2++9H2O=Cl-+6VO3-+18H+.
(4)25℃时,取样进行试验分 析,得到钒沉淀率和溶液pH之间关系如下表:
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为1.7-1.8.
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<2.6×10-3mol•L-1.(已知:25℃时,K电[Fe(OH)3]=2.6×10-33)
(5)该工艺流程中,可以循环利用的物质有有机萃取剂和氨气.

请回答下列问题:
(1)步骤①所得废渣的成分是SiO2(写化学式),操作Ⅰ的名称过滤.
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层)
②中萃取时必须加入适量碱,其原因是加入碱中和硫酸,促使平衡正向移动,提高钒的萃取率.
③中X试剂为H2SO4.
(3)④的离子方程式为ClO3-+6VO2++9H2O=Cl-+6VO3-+18H+.
(4)25℃时,取样进行试验分 析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<2.6×10-3mol•L-1.(已知:25℃时,K电[Fe(OH)3]=2.6×10-33)
(5)该工艺流程中,可以循环利用的物质有有机萃取剂和氨气.
13.已知汽车尾气无害化处理反应为:2NO(g)+2CO(g)═N2(g)+2CO2(g),下列说法不正确的是( )
| A. | 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 | |
| B. | 使用高效催化剂可有效提高正反应速率 | |
| C. | 反应达到平衡后,NO的反应速率保持恒定 | |
| D. | 升高温度可使该反应的逆反应速率降低 |
10.关于化学键的叙述中,正确的是( )
| A. | 单质、共价化合物、离子化合物中都存在共价键 | |
| B. | 金属和非金属所形成的化学键均为离子键 | |
| C. | 阴、阳离子通过静电引力而形成的化学键叫做离子键 | |
| D. | 共价化合物中一定不含离子键 |
11.如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )

| A. | 常压下Z的单质沸点最高 | B. | 电负性W小于Y | ||
| C. | W的氢化物比X的氢化物稳定 | D. | R的单质在固态时属于原子晶体 |