题目内容
17.铜锌原电池(如图)工作时,下列叙述正确的是( )
| A. | 正极反应为:Zn-2e-═Zn2+ | B. | 电池反应为:Zn+Cu2+═Zn2++Cu | ||
| C. | 当有1mol电子转移时,锌极减轻65g | D. | 盐桥中的K+移向ZnSO4溶液 |
分析 铜锌原电池中,锌较活泼,为原电池的负极,发生Zn-2e-=Zn2+,铜为正极,发生Cu2++2e-=Cu,原电池工作时,溶液中,阳离子向正极移动,结合电极方程式计算.
解答 解:A、铜为正极,发生Cu2++2e-=Cu,故A错误;
B、电池总反应为锌置换出铜,为Zn+Cu2+=Zn2++Cu,故B正确;
C、根据负极发生Zn-2e-=Zn2+可知,当有2mol电子转移时,消耗1mol锌,即锌极减轻65g,故C错误;
D、在溶液中,阳离子往正极移动,K+移向CuSO4溶液,故D错误;
故选:B.
点评 本题考查原电池的工作原理,注意把握工作原理以及电极方程式的书写,题目难度不大.

练习册系列答案
相关题目
7.与有机物  互为同分异构体,且能与NaOH溶液反应的化合物有( )
互为同分异构体,且能与NaOH溶液反应的化合物有( )
 互为同分异构体,且能与NaOH溶液反应的化合物有( )
互为同分异构体,且能与NaOH溶液反应的化合物有( )| A. | 9 种 | B. | 8 种 | C. | 7 种 | D. | 10 种 |
8.离子方程式:Ca2++HCO3-+OH-→CaCO3↓+H2O不能表示的反应有( )
| A. | 澄清石灰水与碳酸氢钠溶液 | B. | 澄清石灰水与碳酸氢铵溶液 | ||
| C. | 氢氧化钠溶液与碳酸氢钙溶液 | D. | 澄清石灰水与碳酸氢钙溶液 |
5.仅用下表提供的玻璃仪器(非玻璃仪器任选)就能实现相应实验目的是( )
| 选项 | 实验目的 | 玻璃仪器 |
| A | 分离乙醇和乙酸的混合物 | 分液漏斗、烧杯、玻璃棒 |
| B | 用0.10mol/L的盐酸配制 100mL 0.050mol/的盐酸 | 100mL容量瓶、烧杯、玻璃棒、胶头滴管 |
| C | 用溴水、淀粉KI溶液比较 Br2和I2的氧化性强弱 | 试管、胶头滴管 |
| D | 用NH4Cl固体和Ca(OH)2固体制备并收集NH3 | 酒精灯、烧杯、导管、集气瓶 |
| A. | A | B. | B | C. | C | D. | D |
12.用括号内试剂除去下列各物质中的少量杂质,正确的是( )
| A. | 溴苯中的溴(KI溶液) | B. | 乙烷中的乙烯(酸性KMnO4溶液) | ||
| C. | 硝基苯中的NO2(NaOH溶液) | D. | 苯中的己烯(Br2水) |
6.将NO2、NH3、O2混合气22.4L通过稀硫酸后,溶液质量增加了26.7g,气体体积缩小为4.48L.(气体体积均在标况下测定)剩余气体能使带火星的木条着火,则混合气体的平均相对分子质量为(4NO2+O2+2H2O=4HNO3)( )
| A. | 28.1 | B. | 30.2 | C. | 33.1 | D. | 34.0 |
12.( I )向一体积不变的密闭容器中充入2mol A,0.6mol C和一定量的B三种气体,一定条件下发生反应2A(g)+B(g)═3C(g),各物质的浓度随时间变化的关系如图 1所示,其中t0~t1阶段c(B)未画出.图2为反应体系中反应速率随时间变化的情况且t2,t3,t4各改变一种不同的条件.

(1)若t1=15min,则t0~t1阶段以C的浓度变化表示的反应速率v(C)=0.02mol/(L•min).
(2)t3时改变的条件为减小压强或取出部分平衡混合气体,B的起始物质的量为1mol,
(3)t4~t5阶段,若A的物质的量减少了0.01mol,而此阶段中反应体系吸收能量为a kJ,写出此条件下该反应的热化学方程式:2A(g)+B(g)?3C(g)△H=+200aKJ/mol.
(II)在容积可变的密闭容器中发生反应:mA(g)+nB(g)?pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
(1)当压强从2×105 Pa增加到5×105 Pa时,平衡不移动(填:向左,向右,不)
(2)维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是a+bmol.
(3)当压强为1×106 Pa时,此反应的平衡常数表达式:$\frac{[C]{\;}^{p}}{[A]^{m}}$.

(1)若t1=15min,则t0~t1阶段以C的浓度变化表示的反应速率v(C)=0.02mol/(L•min).
(2)t3时改变的条件为减小压强或取出部分平衡混合气体,B的起始物质的量为1mol,
(3)t4~t5阶段,若A的物质的量减少了0.01mol,而此阶段中反应体系吸收能量为a kJ,写出此条件下该反应的热化学方程式:2A(g)+B(g)?3C(g)△H=+200aKJ/mol.
(II)在容积可变的密闭容器中发生反应:mA(g)+nB(g)?pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
(2)维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是a+bmol.
(3)当压强为1×106 Pa时,此反应的平衡常数表达式:$\frac{[C]{\;}^{p}}{[A]^{m}}$.
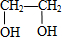 $→_{△}^{浓H_{2}SO_{4}}$ C
$→_{△}^{浓H_{2}SO_{4}}$ C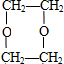 ;
;