题目内容
5.仅用下表提供的玻璃仪器(非玻璃仪器任选)就能实现相应实验目的是( )| 选项 | 实验目的 | 玻璃仪器 |
| A | 分离乙醇和乙酸的混合物 | 分液漏斗、烧杯、玻璃棒 |
| B | 用0.10mol/L的盐酸配制 100mL 0.050mol/的盐酸 | 100mL容量瓶、烧杯、玻璃棒、胶头滴管 |
| C | 用溴水、淀粉KI溶液比较 Br2和I2的氧化性强弱 | 试管、胶头滴管 |
| D | 用NH4Cl固体和Ca(OH)2固体制备并收集NH3 | 酒精灯、烧杯、导管、集气瓶 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.分离乙醇和乙酸应该用蒸馏方法;
B.配制100mL 0.050mol/的盐酸需要100mL容量瓶、烧杯、玻璃棒、胶头滴管、量筒;
C.可在试管中进行实验;
D.反应在大试管中进行,缺少大试管.
解答 解:A.乙醇和乙酸乙酯混溶,分液的方法不能分离,应先加入饱和碳酸钠溶液,然后分离,故A错误;
B.配制一定浓度的溶液,应用量筒量取溶液,缺少量筒,不能完成实验,故B错误;
C.可用胶头滴管将溶液滴在试管中根据反应现象判断氧化性强弱,故C正确;
D.实验室制备氨气应在大试管中进行,题目缺少大使管,故D错误.
故选C.
点评 本题考查物质的检验和鉴别、溶液的配制等试验基本操作,明确实验基本操作及各仪器用途是解本题关键,熟悉常见仪器的使用方法及常见物质的分离提纯方法,题目难度不大.

练习册系列答案
相关题目
13.下列关于容量瓶及其使用方法的叙述中,正确的是( )
①容量瓶是配制一定物质的量浓度的溶液的专用仪器
②使用前要先检查容量瓶是否漏液
③容量瓶可以用来加热
④不能用容量瓶贮存配制好的溶液
⑤可以用500mL 容量瓶配制250mL 溶液.
①容量瓶是配制一定物质的量浓度的溶液的专用仪器
②使用前要先检查容量瓶是否漏液
③容量瓶可以用来加热
④不能用容量瓶贮存配制好的溶液
⑤可以用500mL 容量瓶配制250mL 溶液.
| A. | ①② | B. | ②④ | C. | ①②④⑤ | D. | ①②④ |
20.化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A. | 明矾与水反应成的Al(OH)3胶体能吸附水中悬浮物,可用于净水 | |
| B. | 江河入海口三角洲的形成通常与胶体的性质有关系 | |
| C. | 水泥厂、冶金厂用高压电作用于气溶胶以除去烟尘,是利用了电泳原理 | |
| D. | 溶液中溶质粒子能通过滤纸,胶体中分散质粒子不能通过滤纸 |
10.物质的量相同的下列各组物质,分别在足量的O2中燃烧,所消耗O2 的量相同的一组是( )
| A. | 乙醇、乙二醇 | B. | 丙醇、丁醇 | C. | 丙醇、丙烯 | D. | 丁醇、乙醛 |
17.铜锌原电池(如图)工作时,下列叙述正确的是( )


| A. | 正极反应为:Zn-2e-═Zn2+ | B. | 电池反应为:Zn+Cu2+═Zn2++Cu | ||
| C. | 当有1mol电子转移时,锌极减轻65g | D. | 盐桥中的K+移向ZnSO4溶液 |
14.化学与生活、社会密切相关.下列说法错误的是( )
| A. | 二氧化氮能使织物褪色,对金属材料也有腐蚀作用 | |
| B. | 亚硝酸盐属于食物防腐剂,可以适量地添加于食物中 | |
| C. | 漂白粉在空气中能稳定存在,可用于漂白纸张 | |
| D. | 大量燃烧化石燃料是造成雾霾天气的重要原因 |
15.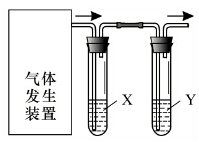 实验室用如图装置完成下表所列的四个实验,不能达到实验目的是( )
实验室用如图装置完成下表所列的四个实验,不能达到实验目的是( )
 实验室用如图装置完成下表所列的四个实验,不能达到实验目的是( )
实验室用如图装置完成下表所列的四个实验,不能达到实验目的是( ) | 选项 | 实验目的 | 试剂X | 试剂Y |
| A | 验证C2H5OH与浓H2SO4加热至170℃制得的乙烯的性质 | NaOH溶液 | Br2水 |
| B | 检验FeSO4受热分解产生的气体中由SO3和SO2 | BaCl2溶液 | 品红溶液 |
| C | 验证电石与饱和食盐水反应生成的乙炔的性质 | CuSO4溶液 | KMnO4溶液 |
| D | 验证氧化性:Cl2>Br2>I2 | NaBr溶液 | KI溶液 |
| A. | A | B. | B | C. | C | D. | D |
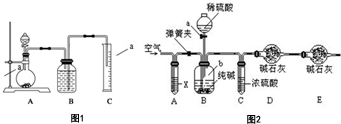 制得的碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案.请回答下列有关问题
制得的碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案.请回答下列有关问题