题目内容
设NA为阿伏伽德罗常数,则下列说法正确的是( )
A、200ml某硫酸盐中含有1.5NA个SO
| ||
| B、一定条件下足量的Fe粉与浓硫酸反应,转移电子数一定为2NA | ||
| C、常温常压下78gNa2O2固体中所含阴、阳离子总数为4NA | ||
| D、电解精炼铜时,若阴极得到电子数为2NA,阳极减少64g |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.根据题中数据判断该硫酸盐中含有的硫酸根离子数目,再计算出该硫酸盐的物质的量浓度;
B.次外层铁粉与浓硫酸发生钝化,阻止了反应的继续进行;
C.过氧化钠中的阴离子为过氧根离子,1mol过氧化钠中含有2mol钠离子、1mol过氧根离子,总共含有3mol离子;
D.粗铜中含有杂质铁,电解过程中铁优先放电,导致阳极减少的质量增多.
B.次外层铁粉与浓硫酸发生钝化,阻止了反应的继续进行;
C.过氧化钠中的阴离子为过氧根离子,1mol过氧化钠中含有2mol钠离子、1mol过氧根离子,总共含有3mol离子;
D.粗铜中含有杂质铁,电解过程中铁优先放电,导致阳极减少的质量增多.
解答:
解:A.某硫酸盐中含有1.5NA个SO42-离子,同时含有NA个金属阳离子,则金属阳离子与硫酸根离子的个数之比为:1:1.5=2:3,即该硫酸盐中含有3个硫酸根离子,则该硫酸盐的物质的量为:1.5mol×
=0.5mol,其浓度为:
=2.5mol/L,故A正确;
B.在常温下,铁与浓硫酸发生钝化,阻止了铁粉与浓硫酸的反应,所以无法计算转移的电子数,故B错误;
C.78g过氧化钠的物质的量为1mol,1mol过氧化钠中含有2mol钠离子、1mol过氧根离子,总共含有3mol阴阳离子,所含阴、阳离子总数为3NA,故C错误;
D.阴极得到电子数为2NA,得到的电子的物质的量为2mol,若完全由金属铜铜提供,则需要1mol铜,质量为64g,由于粗铜中含有较活泼的杂质铁、锌等,放电过程中杂质优先失去电子,所以阳极减少的质量不一定为64g,故D错误;
故选A.
| 1 |
| 3 |
| 0.5mol |
| 0.2L |
B.在常温下,铁与浓硫酸发生钝化,阻止了铁粉与浓硫酸的反应,所以无法计算转移的电子数,故B错误;
C.78g过氧化钠的物质的量为1mol,1mol过氧化钠中含有2mol钠离子、1mol过氧根离子,总共含有3mol阴阳离子,所含阴、阳离子总数为3NA,故C错误;
D.阴极得到电子数为2NA,得到的电子的物质的量为2mol,若完全由金属铜铜提供,则需要1mol铜,质量为64g,由于粗铜中含有较活泼的杂质铁、锌等,放电过程中杂质优先失去电子,所以阳极减少的质量不一定为64g,故D错误;
故选A.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,选项B为易错点,注意明确次外层浓硫酸、浓硝酸与铁、铝发生钝化的现象.

练习册系列答案
相关题目
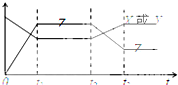 现有反应X(g)+Y(g)?2Z(g),△H<0.如图表示从反应开始到t1s时达到平衡,在t2s时由于条件变化使平衡破坏,到t3s时又达平衡,则在图中t2s时改变的条件可能是( )
现有反应X(g)+Y(g)?2Z(g),△H<0.如图表示从反应开始到t1s时达到平衡,在t2s时由于条件变化使平衡破坏,到t3s时又达平衡,则在图中t2s时改变的条件可能是( )| A、增大了X或Y的浓度 |
| B、增大压强 |
| C、增大Z的浓度 |
| D、升高温度 |
钢铁发生吸氧腐蚀时,负极的电极反应式是( )
| A、Fe-3e-=Fe3+ |
| B、O2+2H2O+4e-=4OH- |
| C、Fe-2e-=Fe2+ |
| D、O2+2H2O-4e-=4OH- |
用酸性氢氧燃料电池为电源进行电解的实验装置如图所示,下列说法正确的是( )

| A、燃料电池工作时,正极反应为:O2+2H2O+4e-═4OH- |
| B、在溶液中SO42-往b极移动 |
| C、若a、b极都是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |
| D、若a极是铜,b极是铁时,a极逐渐溶解,b极上有铜析出 |
FeCl2溶液中混有FeI2杂质,根据已知反应:①2FeCl3+2KI=2FeCl2+2KCl+I2;②2FeCl2+Cl2=2FeCl3;③2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O中的有关事实,要除去其中的FeI2,应选用的试剂是( )
| A、KMnO4 |
| B、过量Cl2 |
| C、FeCl3 |
| D、FeCl2 |
下列关于化工生产原理的叙述中,符合目前工业生产实际的是( )
| A、氯碱工业中,离子交换膜的作用是防止离子运动 |
| B、硫酸、硝酸、合成氨均使用了催化剂 |
| C、石油裂化的主要目的是得到更多的乙烯、丙烯等气态短链烃 |
| D、氯气和氢气混合在光照条件下生成氯化氢,用水吸收得到盐酸 |
 铁及其化合物与生产、生活关系密切.
铁及其化合物与生产、生活关系密切.