题目内容
下列热化学方程式正确的是( )
| A、S(s)+O2(g)═SO2(g);△H=-269.8kJ/mol |
| B、NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+57.3kJ/mol |
| C、表示乙醇的燃烧热:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol |
| D、2NO2═O2+2NO;△H=+116.2kJ/mol |
考点:热化学方程式
专题:化学反应中的能量变化
分析:A、物质的燃烧均为放热反应,而且热化学方程式必须标注物质的状态.
B、从反应吸放热的表示方法的角度来考虑.
C、1 mol可燃物完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热.而且注意生成物的状态C→CO2,H2→H2O(液),S→SO2(气).
D、热化学方程式必须标注物质的状态.
B、从反应吸放热的表示方法的角度来考虑.
C、1 mol可燃物完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热.而且注意生成物的状态C→CO2,H2→H2O(液),S→SO2(气).
D、热化学方程式必须标注物质的状态.
解答:
解:A、物质的燃烧均为放热反应,故△H小于0,而且热化学方程式必须标注物质的状态,故A正确.
B、酸碱中和为放热反应,放热反应的△H小于0,故B错误.
C、1 mol可燃物完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热.而且注意生成H2O必须为液态,故C错误.
D、热化学方程式必须标注物质的状态,故D错误.
故答案为A.
B、酸碱中和为放热反应,放热反应的△H小于0,故B错误.
C、1 mol可燃物完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热.而且注意生成H2O必须为液态,故C错误.
D、热化学方程式必须标注物质的状态,故D错误.
故答案为A.
点评:本题从反应吸放热的表示方法、物质状态的标注等方面考查了热化学方程式的书写,较简单.

练习册系列答案
相关题目
用图所示装置进行实验,不能达到实验目的是( )
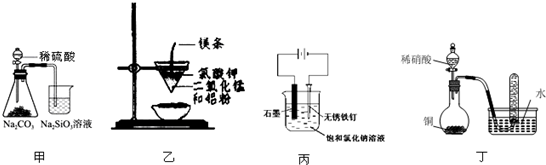

| A、用甲装置比较硫、碳、硅三种元素的非金属性强弱 |
| B、用乙装置可制得金属锰,用同样的装置可制得金属铬 |
| C、用丙装置可实现对铁钉的保护 |
| D、用丁装置验证铜与稀硝酸反应的气体产物只有NO |
下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图象,其中图象和实验结论表达均正确的是( )


| A、①是其他条件一定时,反应速率随温度变化的图象,正反应△H<0 |
| B、②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图象 |
| C、③是在有无催化剂存在下建立的平衡过程图象,a是使用催化剂时的曲线 |
| D、④是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1>p2 |
下列物质中属于共价化合物是( )
| A、Cl2 |
| B、NaOH |
| C、NH4Cl |
| D、HI |
已知:强酸和强碱在稀溶液中发生反应时的中和热为-57.3kJ?mol-1,101kPa时辛烷的燃烧热为5518kJ?mol-1.则下列热化学方程式书写正确的是( )
| A、H++OH-═H2O△H=-57.3 kJ?mol-1 |
| B、2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l)△H=-114.6 kJ?mol-1 |
| C、2C8H18(l)+25O2(g)═16CO2(g)+18H2O(g)△H=-11036 kJ?mol-1 |
| D、2C8H18(l)+25O2(g)═16CO2(g))+18H2O(l)△H=-5518kJ?mol-1 |
下列各族离子在指定溶液中一定能大量共存的是( )
| A、由水电离出的c(OH-)=10-13mol?L-1的溶液中:Na+、Ba2+、Cl-、Br- | ||
B、
| ||
| C、含大量Al3+的溶液中:K+、Na+、ClO-、SO42- | ||
| D、无色溶液中:K+、Na+、SO42-、MnO4- |
 瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(图甲)的传感器煤矿巷道中的甲烷达到一定浓度时可以显示.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.下列有关叙述不正确的是( )
瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(图甲)的传感器煤矿巷道中的甲烷达到一定浓度时可以显示.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.下列有关叙述不正确的是( )| A、瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a |
| B、电极b是正极,O2-由电极b流向电极a |
| C、电极a的反应式为:CH4+4O2--8e-=CO2+2H2O |
| D、当固体电解质中有1mol O2-通过时,电子转移2mol |