题目内容
7. 乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:2CO(g)+4H2 (g)═CH3CH2OH(g)+H2O(g)△H=256.1kJ•mol-1
CO(g)+H2O(g)═CO2(g)+H2(g)△H=41.2kJ•mol-1
已知:H2O(l)═H2O(g)△H=+44kJ•mol-1
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g)+6H2(g)═CH3CH2OH(g)+3H2O(l)△H=-305.7kJ•mol-1.
(2)CH4和H2O(g)在催化剂表面发生反应CH4+H2OCO+3H2,该反应在不同温度下的化学平衡常数如下表:
| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
②T℃时,向1L密闭容器中投入1molCH4和1mol H2O(g),平衡时c(CH4)=0.5mol•L-1,该温度下反应CH4+H2═OCO+3H2的平衡常数K=6.75.
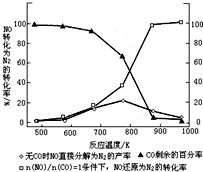
(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.某研究小组在实验室以Ag-ZSM-5 为催化剂,测得NO转化为N2的转化率随温度变化情况如图
①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为该反应是放热反应,升高温度反应更有利于向逆反应方向进行;在$\frac{n(NO)}{n(CO)}$=1的条件下,应控制的最佳温度在870℃左右.
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染.写出CH4与NO2发生反应的化学方程式:CH4+2NO2=CO2+N2+2H2O.
(4)乙醇-空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.该电池负极的电极反应式为CH3CH2OH-12e-+6O2-=2CO2+3H2O.
分析 (1)根据盖斯定律来解答:一个反应不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等);
(2)①图表数据分析平衡常数随温度升高增大,说明升温平衡正向进行,正反应为吸热反应;
②T℃时,向1L密闭容器中投入1molCH4和1mol H2O(g),平衡时c(CH4)=0.5mol•L-1,
CH4+H2O=CO+3H2,
起始量(mol/L) 1 1 0 0
变化量(mol/L) 0.5 0.5 0.5 1.5
平衡量(mol/L) 0.5 0.5 0.5 1.5
平衡常数=等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
(3)①升高温度,发现NO的分解率降低,说明反应向逆反应方向进行,该反应放热;
②CH4与NO2发生反应生成二氧化碳、氮气和水;
(4)乙醇在燃料电池的负极失去12个电子,发生氧化反应生成二氧化碳,用传导离子O2-离子配平电荷守恒、原子守恒写出电极反应.
解答 解:(1)已知反应:2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H=256.1kJ•mol-1 ①
CO(g)+H2O(g)═CO2(g)+H2(g)△H=41.2kJ•mol-1 ②
H2O(l)═H2O(g)△H=+44kJ•mol-1 ③
根据盖斯定律可知,将①-2×③-3×②可得:
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(l)△H=-305.7KJ,
故答案为:-305.7 kJ•mol-1;
(2)①温度升高,平衡常数增大即平衡向正反应方向移动,故该反应为吸热反应,故答案为:吸热;
②T℃时,向1L密闭容器中投入1molCH4和1mol H2O(g),平衡时c(CH4)=0.5mol•L-1,
CH4+H2O=CO+3H2,
起始量(mol/L) 1 1 0 0
变化量(mol/L) 0.5 0.5 0.5 1.5
平衡量(mol/L) 0.5 0.5 0.5 1.5
该温度K=$\frac{[CO][{H}_{2}]^{3}}{[C{H}_{4}][{H}_{2}O]}$=$\frac{0.5×1.{5}^{3}}{0.5×0.5}$=6.75,
故答案为:6.75;
(3)①升高温度,发现NO的分解率降低,说明反应向逆反应方向进行,该反应放热;由图可知,在$\frac{n(NO)}{n(CO)}$=1的条件下,870℃时,NO还原为N2的转化率为100%,
故答案为:该反应是放热反应,升高温度反应更有利于向逆反应方向进行;870℃;
②CH4与NO2发生反应生成无毒的N2、CO2和H2O,反应为CH4+2NO2=CO2+N2+2H2O,故答案为:CH4+2NO2=CO2+N2+2H2O;
(4)乙醇在燃料电池的负极失去12个电子,发生氧化反应,电极反应式为CH3CH2OH-12e-+6O2-=2CO2+3H2O,故答案为:CH3CH2OH-12e-+6O2-=2CO2+3H2O.
点评 本题考查盖斯定律的应用、放热反应与吸热反应、热化学方程式的书写、原电池原理,难度中等.根据图象分析出分解率的变化特点是解题的关键.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | VC=0.75mol/(L.min) | B. | VB=0.3mol/(L.min) | ||
| C. | VA=0.8mol/(L.min) | D. | VD=1mol/(L.min) |
| A. | 化合反应 | B. | 中和反应 | C. | 氧化还原反应 | D. | 复分解反应 |
| A. | HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的2倍 | |
| C. | 室温下,pH=3的亚硫酸溶液中的氢离子浓度与pH=11的氨水中的氢氧根离子浓度相等 | |
| D. | 室温时,将pH=5的H2SO4溶液稀释1000倍,则c(H+):c (SO42-)=2:1 |
| A. |  萃取分离 | B. |  转移溶液 | C. |  量取液体 | D. |  称取NaOH固体 称取NaOH固体 |

| A. | 装置①储存液溴 | B. | 装置②提纯含少量水的乙醇 | ||
| C. | 装置③不能用来吸收HCl气体 | D. | 装置④分离CCl4和水 |
| A. | 常温下,1L0.1 mol/L的NH4NO3溶液中铵根离子为0.1NA | |
| B. | 室温下,16g O2与O3的混合气体中,含氧原子总数为NA | |
| C. | 1 mol Cl2参加反应转移的电子数一定为2NA | |
| D. | 含NA个Na+的NaOH溶解于1L水中,Na+的物质的量浓度为1 mol/L |
| A. | 用浓H2SO4刻蚀工艺玻璃上的纹饰 | |
| B. | 高纯度的硅单质广泛用于制作光导纤维 | |
| C. | 漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的 | |
| D. | 制饭勺、饭盒、高压锅等的不锈钢是合金 |