题目内容
12.下列说法正确的是( )| A. | 标准状况下,将2.24L Cl2溶于水,可得到HClO分子的数目是0.1NA | |
| B. | NA个Fe(OH)3胶体粒子的质量为107g | |
| C. | 8.0gCu2S和CuO的混合物中含有铜原子数为0.1NA | |
| D. | 2.3gNa与氧气完全反应,反应中转移的电子数介于0.1NA到0.2NA之间 |
分析 A.氯气和水的反应为可逆反应;
B.胶体粒子是氢氧化铁的微粒集合体;
C.Cu2S的摩尔足量是CuO的2倍,含有的铜原子也是CuO的2倍;
D.根据Na元素的化合价变化计算.
解答 解:A.标况下2.24L氯气的物质的量为0.1mol,氯气和水的反应为可逆反应,故不能反应完全,则生成的HClO的分子个数小于0.1NA个,故A错误;
B.胶体粒子守恒氢氧化铁的微粒集合体,NA个Fe(OH)3胶体粒子的质量不是107g,故B错误;
C.Cu2S的摩尔质量是CuO的2倍,含有的铜原子也是CuO的2倍,故8.0g混合物可以认为均由CuO构成,故含有的CuO的物质的量为n=$\frac{8g}{80g/mol}$=0.1mol,则含0.1NA个铜原子,故C正确;
D.Na元素的化合价从0变化为+1价,转移1个电子,所以2.3gNa与氧气完全反应,反应中转移的电子数为0.1NA,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数,注意物质的组成、结构、性质,熟练掌握公式的使用和物质的结构是解题关键,题目难度不大.

练习册系列答案
 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
6.同位素的不同核素具有不同的( )
| A. | 核电荷数 | B. | 质子数 | C. | 中子数 | D. | 电子数 |
3.下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中: c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | 20mL 0.1mol/L CH3COONa溶液与10mL 0.1mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 已知某温度下,Ksp(AgCl)=1×10-10,Ksp(Ag2CrO4)=1×10-12.若将0.001mol•L-1AgNO3溶液滴入浓度均为0.001 mol•L-1的KCl和K2CrO4混合溶液中,则先产生Ag2CrO4沉淀 |
17.某化合物由两种单质直接反应生成,将其加(通)入Ba(HCO3)2溶液中同时有气体和沉淀产生.下列化合物中符合上述条件的是( )
| A. | SO3 | B. | HCl | C. | FeCl2 | D. | Na2O2 |
1.下列对第ⅣA族元素及其化合物的性质的推断一定不正确的是( )
| A. | 与同族硅元素类似,锗、锡、铅都可用做半导体材料 | |
| B. | 锗与盐酸可能不反应,锡、铅能与盐酸反应 | |
| C. | 锗、锡、铅的+4价氢氧化物的碱性由弱到强的顺序为:Ge(OH)4<Sn(OH)4<Pb(OH)4 | |
| D. | 锗、锡、铅的金属性依次减弱 |
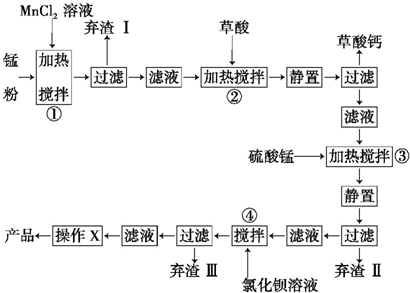
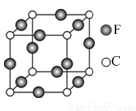
 =5SO2-4+2Mn2+ +3H2O
=5SO2-4+2Mn2+ +3H2O