题目内容
将2.0g铜镁合金完全溶于浓HNO3,若反应中硝酸被还原后只产生1.12LNO2气体和168mL N2O4气体(均已折算成标准状况下),在反应后的溶液中,加入足量的氢氧化钠溶液,产生沉淀的质量为( )
| A、3.165g |
| B、3.105g |
| C、4.255g |
| D、5.625g |
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:最终沉淀为氢氧化铜、氢氧化镁,铜和镁失去的电子的物质的量,等于硝酸被还原为二氧化氮、四氧化二氮获得的电子的物质的量,等于他们结合的氢氧根的物质的量,
根据氮的氧化物计算氢氧根的物质的量,沉淀的总质量=金属质量+氢氧根的质量.
根据氮的氧化物计算氢氧根的物质的量,沉淀的总质量=金属质量+氢氧根的质量.
解答:
解:1.12L的NO2气体的物质的量为
=0.05mol,168mL的N2O4气体的物质的量为
=0.0075mol,
所以金属提供的电子的物质的量为0.05mol×(5-4)+0.0075mol×2×(5-4)=0.065ol,
所以沉淀中含有氢氧根的物质的量为0.065mol,氢氧根的质量为0.0655mol×17g/mol=1.105g,
所以生成沉淀的质量为2g+1.105g=3.105g.
故选B.
| 1.12L |
| 22.4L/mol |
| 0.168L |
| 22.4L/mol |
所以金属提供的电子的物质的量为0.05mol×(5-4)+0.0075mol×2×(5-4)=0.065ol,
所以沉淀中含有氢氧根的物质的量为0.065mol,氢氧根的质量为0.0655mol×17g/mol=1.105g,
所以生成沉淀的质量为2g+1.105g=3.105g.
故选B.
点评:本题考查氧化还原反应的计算,题目难度中等,本题解答的关键是铜和镁失去的电子的物质的量,等于他们结合的氢氧根的物质的量,而结合氢氧根的质量就正好是沉淀增加的质量.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
光纤通讯是70年代后期发展起来的一种新型通信技术,目前长距离光纤通讯系统已经投入使用.光纤通讯的光导纤维是由下列哪种物质经特殊工艺制成( )
| A、石墨 | B、二氧化硅 |
| C、氧化镁 | D、硅 |
室温下由水电离产生的c(H+)=10-12 mol?L-1的溶液中,一定能大量共存的离子组是( )
| A、Cl-、SO42-、Na+、K+ |
| B、NH4+、Ba2+、Cl-、NO3- |
| C、SO42-、NO3-、Fe2+、Mg2+ |
| D、Na+、K+、ClO-、OH- |
反应3Fe(s)+4H2O (g)
Fe3O4(s)+4H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
| ||
| A、增加铁的量 |
| B、将容器体积缩小一半 |
| C、升高温度 |
| D、压强不变,充入N2使容器体积增大 |
某同学在实验室中用KClO3代替MnO2制备Cl2,反应原理为KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O.下列叙述不正确的是( )
| A、氧化剂为KClO3,其中Cl元素被还原 |
| B、若有3molH2O生成,则反应中有6mol电子转移 |
| C、浓HCl在反应中起酸性和还原性的作用 |
| D、氧化剂与还原剂的物质的量之比为1:5 |
下列有关说法正确的是( )
| A、1mol H2燃烧放出的热量为H2的燃烧热 |
| B、饱和石灰水中加入少量CaO,恢复至室温后溶液的c(Ca2+)不变 |
| C、铅蓄电池放电过程中,正极质量增加,负极质量减小 |
| D、为除去FeCl3溶液中的CuCl2,可通入H2S |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、标准状况下,22.4 L H2O的分子数为1 NA |
| B、物质的量浓度为0.5 mol?L-1的MgCl2溶液,含有Cl-数为1 NA |
| C、64 g SO2中含有的氧原子数为1NA |
| D、常温常压下,14 g N2含有分子数为0.5 NA |
在含有Na+、Cl-、K+、SO42-的混合溶液中,测得c(Na+)=2mol/L,c(K+)=2mol/L,c(Cl-)=2mol/L,则c(SO42-)等于( )
| A、1mol/L |
| B、0.5mol/L |
| C、1.5mol/L |
| D、2mol/L |
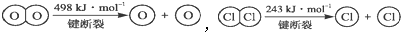 ,断开1molH-O键与断开1mol H-Cl键所需能量相差约为
,断开1molH-O键与断开1mol H-Cl键所需能量相差约为