题目内容
6.下列说法正确的是( )| A. | 化合物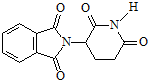 的分子式为C13H9O4N2 的分子式为C13H9O4N2 | |
| B. | 在碱性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH | |
| C. | 在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应 | |
| D. | 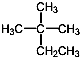 的系统命名为2-甲基-2-乙基丙烷 的系统命名为2-甲基-2-乙基丙烷 |
分析 A.根据结构简式确定分子式;
B.碱性条件下,酯水解生成酸式盐和醇;
C.含有羧基、酚羟基或肽键的物质在一定条件下能与NaOH反应;
D.该分子中最长的碳链含有4个碳原子,有两个甲基分别位于2号碳原子上.
解答 解:A.根据结构简式确定分子式为C13H10O4N2,故A错误;
B.碱性条件下,酯水解生成酸式盐和醇,在酸性条件下酯水解生成羧酸和醇,则该物质在碱性条件下水解应该生成乙酸盐和C2H518OH,故B错误;
C.含有羧基、酚羟基或肽键的物质在一定条件下能与NaOH反应,乙酸、氨基酸都含有羧基而蛋白质含有肽键,所以这几种物质都能与NaOH反应,故C正确;
D.该分子中最长的碳链含有4个碳原子,有两个甲基分别位于2号碳原子上,其名称是2,2-二甲基丁烷,故D错误;
故选C.
点评 本题考查有机物结构和性质及有机物命名,为高频考点,明确官能团及其性质关系、有机反应命名方法、有机物在反应前后断键和成键方式是解本题关键,易错选项是B,注意酯在酸性和碱性条件下水解区别.

练习册系列答案
相关题目
16.有一真空密闭容器中,盛有amolPCl5,加热到200℃时,发生如下反应PCl5(g)?PCl3(g)+Cl2(g),反应达平衡时,PCl5所占体积分数为M%,若在同一温度下,同一容器中,最初投入2amolPCl5反应达平衡时,PCl5所占体积分数为N%,则M与N的关系正确的是( )
| A. | M<N | B. | 2M=N | C. | N<M | D. | M=N |
17.某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去).
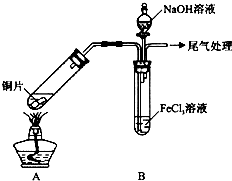
(1)实验前,应先检查装置的气密性;实验中产生的尾气应通人NaOH溶液.
(2)实验过程中需要配制100mL1mol/L FeCl3溶液(未用浓盐酸酸化),所需要的玻璃仪器有:烧杯、量筒、玻璃棒、100mL容量瓶、胶头滴管.
(3)该小组同学向5mL lmol/L FeCl3溶液中通人足量的SO2,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是开始无现象,然后产生白色沉淀.
(4)该小组同学在(3)中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象,最终溶液呈浅绿色.
【查阅资料】Fe(HSO3)2+离子在溶液中呈红棕色且具有较强的还原性,能被Fe3+氧化为SO42-.
Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+.
(5)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了如下实验:
向步骤①和步骤②所得溶液中加入某种试剂,溶液立即出现蓝色沉淀,则该试剂中含有溶质的化学式是K3[Fe(CN)6].
(6)综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程.

(1)实验前,应先检查装置的气密性;实验中产生的尾气应通人NaOH溶液.
(2)实验过程中需要配制100mL1mol/L FeCl3溶液(未用浓盐酸酸化),所需要的玻璃仪器有:烧杯、量筒、玻璃棒、100mL容量瓶、胶头滴管.
(3)该小组同学向5mL lmol/L FeCl3溶液中通人足量的SO2,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是开始无现象,然后产生白色沉淀.
(4)该小组同学在(3)中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象,最终溶液呈浅绿色.
【查阅资料】Fe(HSO3)2+离子在溶液中呈红棕色且具有较强的还原性,能被Fe3+氧化为SO42-.
Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+.
(5)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了如下实验:
| 步骤② | 往5mL1mol•L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热3min,溶液颜色变为浅绿色. |
| 步骤③ | 往5mL重新配制的1mol•L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.几分钟后,发现溶液颜色变成浅绿色. |
(6)综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程.
14.下列有关化学用语表示正确的是( )
| A. | Cl原子的结构示意图: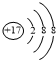 | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | NH4Cl的电子式: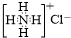 | D. | 间硝基甲苯的结构简式: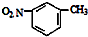 |
1.已知:pKa=-lgKa,25℃时,H2SO3的 pKa1=1.85,pKa2=7.19.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH).下列说法错误的是( )
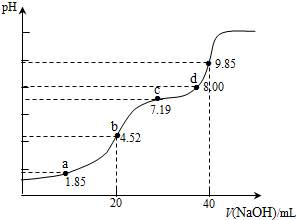

| A. | a点所得溶液中:2c(H2SO3)+c(SO32-)=0.1 mol•L-1 | |
| B. | b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | |
| C. | c点所得溶液中:c(SO32-)=c(HSO3-) | |
| D. | d点所得溶液中:c(Na+)>c(SO32-)>c(HSO3-) |