题目内容
过氧化氢(H2O2)的水溶液俗称双氧水,近年来倍受人们的青睐,被称为“绿色氧化剂”.
(1)写出H2O2的电子式
(2)你认为H2O2被称为“绿色氧化剂”的主要原因是
(3)将双氧水加入用盐酸酸化的FeCl2溶液中,溶液由浅绿色变为棕黄色,写出该反应的离子方程式为 ,反应中H2O2作 剂
(4)双氧水能使酸性高锰酸钾溶液褪色,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里: MnO4-+ H2O2+ H+═ Mn2++ H2O+ .
(1)写出H2O2的电子式
(2)你认为H2O2被称为“绿色氧化剂”的主要原因是
(3)将双氧水加入用盐酸酸化的FeCl2溶液中,溶液由浅绿色变为棕黄色,写出该反应的离子方程式为
(4)双氧水能使酸性高锰酸钾溶液褪色,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里:
考点:氧化还原反应,电子式,氧化还原反应方程式的配平
专题:
分析:(1)为共价化合物,含2个O-H和1个O-O键;
(2)H2O2的还原产物是水;
(3)双氧水具有氧化性,能把亚铁离子氧化生成铁离子;
(4)氧化还原反应中得失电子数相等.
(2)H2O2的还原产物是水;
(3)双氧水具有氧化性,能把亚铁离子氧化生成铁离子;
(4)氧化还原反应中得失电子数相等.
解答:
解:Ⅰ.(1)双氧水是一种含有氧氧共价键和氧氢共价键的极性分子,电子式为 ,故答案为:
,故答案为: ;
;
(2)H2O2的还原产物是水,无污染,故答案为:还原产物为水,对环境无污染;
(3)双氧水具有氧化性,能把亚铁离子氧化生成铁离子,反应的方程式是2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;氧化;
(4)双氧水中氧元素的化合价从-1价升高到0价,失去1个电子.而高锰酸钾中锰元素的化合价从+7价降低到+2价,得到2个电子,所以根据电子的得失守恒可知,配平后的反应为2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,
故答案为:2;5;6;2;8;5O2↑.
 ,故答案为:
,故答案为: ;
;(2)H2O2的还原产物是水,无污染,故答案为:还原产物为水,对环境无污染;
(3)双氧水具有氧化性,能把亚铁离子氧化生成铁离子,反应的方程式是2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;氧化;
(4)双氧水中氧元素的化合价从-1价升高到0价,失去1个电子.而高锰酸钾中锰元素的化合价从+7价降低到+2价,得到2个电子,所以根据电子的得失守恒可知,配平后的反应为2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,
故答案为:2;5;6;2;8;5O2↑.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应配平及分析、应用能力的考查,题目难度不大.

练习册系列答案
相关题目
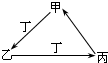 甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下图转化关系.下列有关物质的推断正确的是( )
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下图转化关系.下列有关物质的推断正确的是( )| A、若甲为焦炭,则丁可能是O2 |
| B、若甲为Fe,则丁可能是Cl2 |
| C、若甲为AlCl3,则丁可能是NH3 |
| D、若甲为NaHCO3,则丁可能是HCl |
下列各组烃的混合物,只要总质量一定,按任意比例混合,完全燃烧后生成的CO2和H2O都是恒量的是( )
| A、C2H2、C2H4 |
| B、C2H4、C4H6 |
| C、C2H6、C3H6 |
| D、C6H6、C2H2 |
化学与社会、生产、生活密切相关.下列说法正确的是( )
| A、加快化石燃料的开采和使用 |
| B、NaHCO3可用于治疗胃酸过多 |
| C、明矾可用于水的杀菌消毒 |
| D、从海水中提取物质都必须通过化学反应才能实现 |
下列物质中属于电解质的是( )
| A、硫酸钡 | B、氮气 | C、铜 | D、蔗糖 |
在给定条件下,下列加点的物质在化学反应中能完全消耗的是( )
A、用50 mL 10 mol?L-1
| ||||||
B、向100 mL 3 mol?L-1 稀硝酸中加入5.6 g
| ||||||
C、标准状况下,将1 g
| ||||||
D、一定条件下,1 mol
|