题目内容
用Cl2生产某些含氯有机物时会产生副产物HCl.利用反应A,可实现氯的循环利用.反
应A:4HCl+O2
2Cl2+2H2O
已知:ⅰ.反应A中,1mol HCl被氧化,放出28.9kJ的热量.
ⅱ.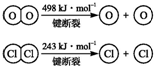
(1)反应A的热化学方程式是 .
(2)断开1mol H-O键与断开1mol H-Cl键所需能量相差约为 kJ,H2O中H-O键比HCl
中H-Cl键(填“强”或“弱”) .
(3)大气中的部分碘源于O3对海水中I-的氧化.O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g)═IO-(aq)+O2(g)△H1
②IO-(aq)+H+(aq)?HIO(aq)△H2
③HIO(aq)+I-(aq)+H+(aq)?I2(aq)+H2O(l)△H3
总反应的化学方程式为 ,其反应热△H= .
应A:4HCl+O2
| ||
| 400℃ |
已知:ⅰ.反应A中,1mol HCl被氧化,放出28.9kJ的热量.
ⅱ.

(1)反应A的热化学方程式是
(2)断开1mol H-O键与断开1mol H-Cl键所需能量相差约为
中H-Cl键(填“强”或“弱”)
(3)大气中的部分碘源于O3对海水中I-的氧化.O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g)═IO-(aq)+O2(g)△H1
②IO-(aq)+H+(aq)?HIO(aq)△H2
③HIO(aq)+I-(aq)+H+(aq)?I2(aq)+H2O(l)△H3
总反应的化学方程式为
考点:有关反应热的计算
专题:
分析:(1)反应A中,4mol HCl被氧化,放出115.6kJ的热量,依据热化学方程式书写方法,标注物质聚集状态和对应焓变写出;
(2)依据反应A中,4mol HCl被氧化,放出115.6kJ的热量,焓变=反应物断键吸收热量-生成物形成化学键放出热量计算.
(3)根据题给信息,总反应为O3氧化I-生成I2,根据盖斯定律,将所给的三个反应:①+②+③可得总反应以及△H.
(2)依据反应A中,4mol HCl被氧化,放出115.6kJ的热量,焓变=反应物断键吸收热量-生成物形成化学键放出热量计算.
(3)根据题给信息,总反应为O3氧化I-生成I2,根据盖斯定律,将所给的三个反应:①+②+③可得总反应以及△H.
解答:
解:(1)依据反应A中,4mol HCl被氧化,放出115.6kJ的热量,反应的热化学方程式为:4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol,
故答案为:4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol;
(2)焓变=反应物断键吸收热量-生成物形成化学键放出热量,4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol,
4×E(H-Cl)+498-[243×2+4×E(H-O)]=-115.6,得到4×E(H-O)-4×E(H-Cl)=498-486+115.6=127.6
E(H-O)-E(H-Cl)=31.9≈32,H2O中H-O键比HCl中H-Cl键强,
故答案为:32;强;
(3)将所给的三个反应:①+②+③可得总反应:2I-(aq)+O3(g)+2H+(aq)?I2(aq)+O2(g)+H2O(l),△H=△H1+△H2+△H3,
故答案为:2I-+O3+2H+?I2+O2+H2O;△H1+△H2+△H3.
故答案为:4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol;
(2)焓变=反应物断键吸收热量-生成物形成化学键放出热量,4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol,
4×E(H-Cl)+498-[243×2+4×E(H-O)]=-115.6,得到4×E(H-O)-4×E(H-Cl)=498-486+115.6=127.6
E(H-O)-E(H-Cl)=31.9≈32,H2O中H-O键比HCl中H-Cl键强,
故答案为:32;强;
(3)将所给的三个反应:①+②+③可得总反应:2I-(aq)+O3(g)+2H+(aq)?I2(aq)+O2(g)+H2O(l),△H=△H1+△H2+△H3,
故答案为:2I-+O3+2H+?I2+O2+H2O;△H1+△H2+△H3.
点评:本题考查了盖斯定律的运用和热化学方程式的书写,注意反应原理的掌握,难度不大.

练习册系列答案
相关题目
下列反应是工业生产硝酸的一个反应过程,4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-1025kJ/mol,若反应物起始的物质的量相同.下列关于该反应的示意图不正确的是( )
A、 |
B、 |
C、 |
D、 |
如图甲池和乙池中的四个电极都是惰性材料,请根据图示判断下列说法正确的是( )


| A、甲池中,b电极是负极 |
| B、a电极的电极反应式C2H5OH+16OH--12e-=2CO32-+11H2O |
| C、一段时间后,用湿润淀粉KI试纸靠近乙池d电极变蓝放电 |
| D、乙池在反应前后溶液的pH不变 |
硬铝的主要成分是( )
| A、纯铝 | B、钢化玻璃 |
| C、沙子 | D、镁铝合金 |
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O=2NO+HNO3+9HF下列有关该反应的说法正确的是( )
| A、NF3是氧化剂,H2O是还原剂 |
| B、还原剂和氧化剂的物质的量之比是2:1 |
| C、若生成0.2mol HNO3,则转移0.4mol电子 |
| D、NF3在潮湿的空气中泄漏会产生红棕色气体 |
在298K、1.01×105 Pa下,将22g CO2通入750mL 1mol/L NaOH溶液中充分反应,测得反应放出x kJ的热量.已知在该条件下,1mol CO2通入1 L 2mol/L NaOH溶液中充分反应放出y kJ的热量,则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是( )
| A、CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x)kJ/mol |
| B、CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y)kJ/mol |
| C、CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y)kJ/mol |
| D、CO2(g)+2NaOH(l)═2 NaHCO3(l)△H=-(8x-2y)kJ/mol |
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O═2NO+HNO3+9HF,下列有关该反应的说法正确的是( )
| A、NF3是氧化剂,H2O是还原剂 |
| B、还原剂和氧化剂的物质的量之比为2:1 |
| C、若生成0.2mol HNO3,则转移0.4mol电子 |
| D、按照树状分类法的分类原则,NF3属于盐 |
下列说法中,正确的是( )
| A、CO的摩尔质量是28 g |
| B、常温常压下,1 mol N2的体积是22.4 L |
| C、18gH2O含有的氢原子总数为2×6.02×1023 |
| D、0.1 mol/L Na2SO4溶液中,Na+的物质的量浓度为 0.1 mol/L |
下列说法不正确的是( )
| A、水常温下呈液态,冰浮在水上,均与氢键有关 | ||||
| B、用于航天工业的氢氧燃料电池的电解质,使用H2SO4的效果比KOH好 | ||||
| C、SO2、氮氧化物和可吸处颗粒物是造成雾霾的一个重要原因 | ||||
D、
|