题目内容
7.下列化学用语正确的是( )| A. | 乙酸的结构简式 C2H4O2 | B. | 氯化钠的电子式: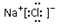 | ||
| C. | 硫原子的原子结构示意图: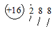 | D. | 水的电离方程式 2H2O═H3O++OH- |
分析 A.乙酸含有羧基,C2H4O2为分子式;
B.氯化钠为离子化合物;
C.硫原子最外层有6个电子;
D.水为弱电解质,不能完全电离.
解答 解:A.乙酸含有羧基,C2H4O2为分子式,结构简式为CH3COOH,故A错误;
B.氯化钠为离子化合物,电子式为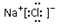 ,故B正确;
,故B正确;
C.硫原子最外层有6个电子,原子结构示意图为 ,故C错误;
,故C错误;
D.水为弱电解质,不能完全电离,应为 2H2O?H3O++OH-,故D错误.
故选B.
点评 本题考查了常见化学用语的表示方法判断,为高频考点,侧重考查双基知识,注意掌握电子式、元素符号、结构简式、比例模型与球棍模型的概念及正确表示方法,题目难度中等.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
17.常温下,分别取“银镜反应”(少许葡萄糖与过量银氨溶液作用)过滤后的剩余溶液,并向其中加入指定物质,反应后的溶液中主要存在的一组离子(有机物除外)正确的是( )
| A. | 通入过量的NH3(g):Ag+、NH4+、NO3-、OH- | |
| B. | 加入过量 HNO3(aq):NH4+、Ag+、H+、NO3- | |
| C. | 通入过量 HCl(g):NH4+、H+、Cl-、NO3- | |
| D. | 加入过量NaOH(aq):NH4+、Na+、NO3-、OH- |
18.下列有关物质性质与应用的说法都正确,且性质能解释应用的是( )
| 选项 | 性质 | 应用 |
| A | Na2O2与水、CO2反应 | 潜水艇O2的来源 |
| B | 单质镁有强还原性 | 镁合金作飞机材料 |
| C | 次氯酸及其盐具有漂白性 | 净化饮用水 |
| D | 铜不与O2反应 | 制备铜币 |
| A. | A | B. | B | C. | C | D. | D |
2.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 0.5 mol O3与11.2 L O2所含的分子数一定相等 | |
| B. | 标准状况下,11.2 L由N2与CO组成的混合气体含有的原子数目为NA | |
| C. | 标准状况下,22.4 L的CCl4中含有的CCl4分子数为NA | |
| D. | 常温常压下,22.4 L的NO2和CO2混合气体含有2NA个氧原子 |
12.设NA为阿伏伽德罗常数的值,下列有关说法正确的是( )
| A. | 在1L 0.1mol/L的Na2CO3溶液中,阴离子总数小于0.1NA | |
| B. | 常温常压下,17 g甲基(-14CH3)所含的电子数为9NA | |
| C. | 标准状况下,2.24L甲醇中含有C-H键的数目为0.3NA | |
| D. | 将1mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA |
16.现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚(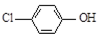 ),同时利用此装置的电能在铁上镀铜,下列说法正确的是( )
),同时利用此装置的电能在铁上镀铜,下列说法正确的是( )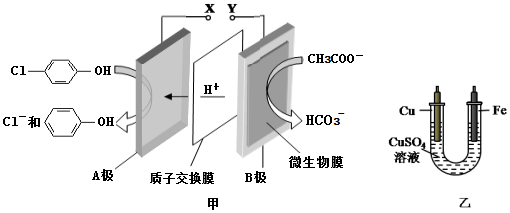
 ),同时利用此装置的电能在铁上镀铜,下列说法正确的是( )
),同时利用此装置的电能在铁上镀铜,下列说法正确的是( )
| A. | 当外电路中有0.2 mole-转移时,A极区增加的H+的个数为0.1 NA | |
| B. | A极的电极反应式为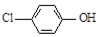 +e-=Cl-+ +e-=Cl-+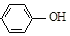 | |
| C. | 铁电极应与Y相连接 | |
| D. | 反应过程中甲中右边区域溶液pH逐渐升高 |
4.在一密闭容器中进行反应:X2(g)+Y2(g)?2Z(g),若X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡状态时,下列说法正确的是( )
| A. | Z的浓度可能为0.3mol/L | |
| B. | 平衡时X2、Y2的转化率相等 | |
| C. | 平衡时,Y2和Z的生成速率之比为2:1 | |
| D. | 若平衡后再改变外界条件,升高温度,则反应的平衡常数将变大 |
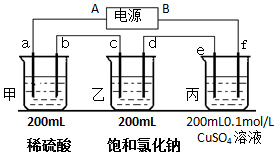 用上面的电池对下物质进行电解,其中a、b、c、d、e、f电极均为惰性电极,通电后,a极产生的气体明显多于b极,2分钟后,测得乙池的pH为12,则
用上面的电池对下物质进行电解,其中a、b、c、d、e、f电极均为惰性电极,通电后,a极产生的气体明显多于b极,2分钟后,测得乙池的pH为12,则