题目内容
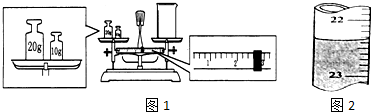
20.(1)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图1.由图中可以看出,该烧杯的实际质量为27.4g.滴定管中的液面如图2所示,正确的读数为22.35mL.
(2)如图3,指出下面3个实验中各存在的一个错误:
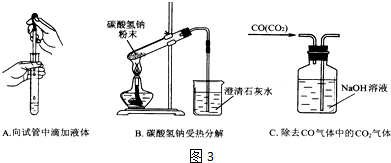
A滴管伸入到试管内,B加热的试管口向上倾斜,C进气管没有伸入液面下,瓶内出气管伸入液面下.
分析 (1)该同学的操作错误是物码倒置,则左盘砝码质量=右盘物体质量+游码质量,所以右盘物体质量=左盘砝码质量-游码质量;滴定管的最小刻度是0.1ml,且小刻度在上;
(2)A.胶头滴管伸入试管中会污染试剂;
B.试管口应略向下倾斜;
C.洗气装置导管应长进短出.
解答 解:(1)该同学的操作错误是物码倒置,则左盘砝码质量=右盘物体质量+游码质量,所以右盘物体质量=左盘砝码质量-游码质量=30-2.6=27.4g;滴定管的最小刻度是0.1ml,且小刻度在上,液面读数应为:22.35ml,故答案为:27.4;22.35;
(2)A、向试管中滴加溶液时,滴管不能伸入试管中,否则造成污染.B、加热碳酸氢钠固体时有水蒸气生成,所以试管口必须低于试管低,否则会炸裂试管.C、洗气装置中,长导管为进气口,短导管为出气口,故答案为:滴管伸入到试管内;加热的试管口向上倾斜;进气管没有伸入液面下,瓶内出气管伸入液面下.
点评 本题考查化学实验常用仪器和基本操作,题目难度不大,注意基础知识的积累.

练习册系列答案
相关题目
10.下列化合物能用相应元素的单质直接化合生成的是( )
①CuS ②FeS ③Al2S3 ④Fe2S3 ⑤Cu2S ⑥FeCl2⑦H2S ⑧FeCl3.
①CuS ②FeS ③Al2S3 ④Fe2S3 ⑤Cu2S ⑥FeCl2⑦H2S ⑧FeCl3.
| A. | ②③⑤⑦⑧ | B. | ①④⑥⑦ | C. | ②③⑤⑥⑦ | D. | ④⑥⑦⑧ |
11.下列说法正确的是( )
| A. | 双氧水、高锰酸钾溶液可以完全灭活埃博拉病毒,其消毒原理与漂白粉消毒饮用水的原理相同 | |
| B. | 不法商家制取的“地沟油”具有固定的熔沸点 | |
| C. | 食品保鲜膜按材质可分为聚乙烯(PE)、聚氯乙烯(PVC)等,PVC的单体可由PE的单体与氯化氢加成制得 | |
| D. | 乙醇用作医用消毒剂时,无水乙醇消毒效果最好 |
15. 某高校研究课题组利用生物发酵技术生产灵芝酸单体的分子结构图如图所示,下列关于该有机物的说法不正确的是( )
某高校研究课题组利用生物发酵技术生产灵芝酸单体的分子结构图如图所示,下列关于该有机物的说法不正确的是( )
 某高校研究课题组利用生物发酵技术生产灵芝酸单体的分子结构图如图所示,下列关于该有机物的说法不正确的是( )
某高校研究课题组利用生物发酵技术生产灵芝酸单体的分子结构图如图所示,下列关于该有机物的说法不正确的是( )| A. | 能与Br2发生加成反应 | B. | 能发生酯化反应 | ||
| C. | 能发生水解反应 | D. | 分子中有7个手性碳原子 |
5.可以用分液漏斗分离的一组液体混合物是( )
| A. | 溴和四氯化碳 | B. | 苯和溴苯 | C. | 汽油和苯 | D. | 溴苯和水 |
9.元素X的原子有3个电子层,最外层有4个电子.这种元素位于周期表的( )
| A. | 第4周期ⅢA族 | B. | 第4周期ⅦA族 | C. | 第3周期Ⅳ族 | D. | 第3周期ⅣA族 |
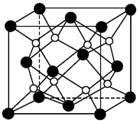 (1)原子序数小于36的X、Y、Z、W四种元素,其中X是元素周期表中原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.回答下列问题:
(1)原子序数小于36的X、Y、Z、W四种元素,其中X是元素周期表中原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.回答下列问题: