题目内容
11.某固体物质和某溶液在一定条件下反应,产生气体(恢复至常温)的平均相对分子质量为45.8,则发生反应的物质不可能是( )| A. | Zn和浓H2SO4 | B. | C和浓HNO3 | ||
| C. | Cu和浓HNO3 | D. | Na2O2和NH4Cl浓溶液 |
分析 某固体物质和某溶液在一定条件下反应,产生气体(恢复至常温)的平均相对分子质量为45.8,若为混合气体,气体的相对分子质量有大于45.8的,也有小于45.8的,结合物质的性质及生成气体的相对分子质量来解答.
解答 解:A.反应生成SO2和H2的混合物,二氧化硫的相对分子质量为64,氢气的相对分子质量为2,则符合题意,故A不选;
B.反应生成CO2和NO2的混合物,相对分子质量分别为44、46,符合题意,故C不选;
D.反应生成NO和NO2的混合物,相对分子质量分别为30、46,符合题意,故C不选;
D.反应生成O2和NH3的混合物,相对分子质量都比45.8小,不符合,故D选;
故选D.
点评 本题物质的性质,为高频考点,把握物质的性质、发生的反应及相对分子质量为解答的关键,注意结合极限法判断气体的相对分子质量关系,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
1. 25℃,电离平衡常数:
25℃,电离平衡常数:
回答下列问题:
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3;pH由大到小的顺序是abdc(填编号)
(2)在Na2CO3溶液中通入少量的SO2气体,写出离子方程式2CO32-+SO2+H2O═2HCO3-+SO32-
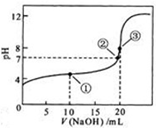
(3)用0.1000mol/L NaOH溶液滴定0.1000mol/L 20mL CH3COOH溶液,得到如图曲线在②时,溶液中离子浓度大小顺序为c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
在①时,测得pH约为5,c(CH3COO-)-c(Na+)=10-5-10-9mol/L(填精确数值)
(4)常温下,CH3COOH与NH3.H2O的电离平衡常数均为1.8×10-5,则NH4HCO3溶液呈碱性.
溴水.
 25℃,电离平衡常数:
25℃,电离平衡常数:| 化学式 | CH3COOH | H2CO3 | HClO | H2SO3 |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=1.5×10-2 K2=1.0×10-7 |
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3;pH由大到小的顺序是abdc(填编号)
(2)在Na2CO3溶液中通入少量的SO2气体,写出离子方程式2CO32-+SO2+H2O═2HCO3-+SO32-
(3)用0.1000mol/L NaOH溶液滴定0.1000mol/L 20mL CH3COOH溶液,得到如图曲线在②时,溶液中离子浓度大小顺序为c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
在①时,测得pH约为5,c(CH3COO-)-c(Na+)=10-5-10-9mol/L(填精确数值)
(4)常温下,CH3COOH与NH3.H2O的电离平衡常数均为1.8×10-5,则NH4HCO3溶液呈碱性.
溴水.
2.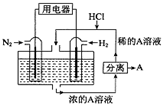 科学家设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电源,又能固氮的新型燃料电池,装置如图所示,下列说法不正确的是( )
科学家设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电源,又能固氮的新型燃料电池,装置如图所示,下列说法不正确的是( )
 科学家设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电源,又能固氮的新型燃料电池,装置如图所示,下列说法不正确的是( )
科学家设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电源,又能固氮的新型燃料电池,装置如图所示,下列说法不正确的是( )| A. | 该电池外电路电流从通入H2的电流流向通入N2的电极 | |
| B. | 反应过程中溶液的pH会变大,故需要加入盐酸 | |
| C. | 通入N2的电极发生的电极反应式为:N2+6e-+8H+═2NH4+ | |
| D. | 通入H2的电极为负极,A为NH4Cl |
19.已知有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化工发展水平.A、B、C、D、E有如下关系:则下列推断不正确的是( )
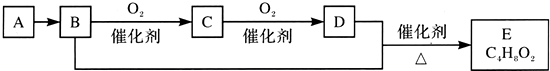

| A. | 鉴别A和甲烷可选择使用酸性高锰酸钾溶液 | |
| B. | D中含有的官能团为羧基,利用D物质可以清除水壶中的水垢 | |
| C. | 物质C的结构简式为CH3CHO,E的名称为乙酸乙酯 | |
| D. | B+D→E的化学方程式为CH3CH2OH+CH3COOH$?_{△}^{催化剂}$CH3COOC2H5 |
6. 燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.
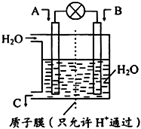
(1)如图所示,利用电化学原理将SO2 转化为重要化工原料C若A为SO2,B为O2,则负极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+;
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2?CH3OH+H2O
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ•mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-b kJ•mol-1;
H2O(g)=H2O(l)△H=-c kJ•mol-1;
CH3OH(g)=CH3OH(l)△H=-d kJ•mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-($\frac{3}{2}$c+2d-a-b)kJ•mol-1;
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①该反应的△H<0(填“>”或“<”),实验2条件下平衡常数K=0.17.
②实验3中,若平衡时,CO的转化率大于水蒸气,则$\frac{a}{b}$的值0<$\frac{a}{b}$<1(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正<V逆(填“<”,“>”,“=”).
④判断该反应达到平衡的依据是AC.
A.CO2减少的化学反应速率和CO减少的化学反应速率相等
B.容器内气体压强保持不变
C.CO、H2O、CO2、H2的浓度都不再发生变化
D.容器中气体的平均相对分子质量不随时间而变化.
 燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.(1)如图所示,利用电化学原理将SO2 转化为重要化工原料C若A为SO2,B为O2,则负极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+;
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2?CH3OH+H2O
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ•mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-b kJ•mol-1;
H2O(g)=H2O(l)△H=-c kJ•mol-1;
CH3OH(g)=CH3OH(l)△H=-d kJ•mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-($\frac{3}{2}$c+2d-a-b)kJ•mol-1;
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则$\frac{a}{b}$的值0<$\frac{a}{b}$<1(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正<V逆(填“<”,“>”,“=”).
④判断该反应达到平衡的依据是AC.
A.CO2减少的化学反应速率和CO减少的化学反应速率相等
B.容器内气体压强保持不变
C.CO、H2O、CO2、H2的浓度都不再发生变化
D.容器中气体的平均相对分子质量不随时间而变化.
16.化学与环境保护密切相关,下列说法不正确的是( )
| A. | PM2.5是指大气中直径≤2,5微米的颗粒物也称为可入肺颗粒物,对人体危害最大是因为它可以直接进入肺泡 | |
| B. | 雾霾是因为汽车排放尾气,工厂排放废气,燃烧烟花爆竹、烹饪等原因所造成的 | |
| C. | 化石能源不仅不可再生,而且在燃烧过程中会产生染污性物质,因此应不再使用化石能源,这符合绿色化学的核心 | |
| D. | 对煤进行气化、液化、脱硫等处理,不仅可以提高其利用率,而且可以降低对环境的污染 |
1.下列变化中,化学键不被破坏的是( )
| A. | 加热NH4Cl | B. | 干冰汽化 | C. | HCl溶于水 | D. | NaOH固体熔化 |
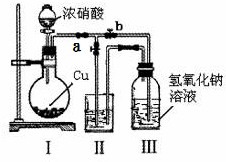 针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动: