题目内容
1.下列物质中,属于共价化合物的是( )| A. | 氯化镁 | B. | 二氧化碳 | C. | 氢气 | D. | 硫酸铜 |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键,含有离子键的化合物为离子化合物,离子化合物中可能含有共价键,只含共价键的化合物为共价化合物.
解答 解:A、氯化镁中镁离子和氯离子之间存在离子键,为离子化合物,故A错误;
B、二氧化碳碳与氧之间是共价键形成的化合物,所以是共价化合物,故B正确;
C、氢气是单质不是化合物,故C错误;
D、硫酸铜中既有离子键,也有共价键形成的离子化合物,故D错误;
故选B.
点评 本题考查了化学键和化合物的关系,明确离子化合物和共价键化合物的概念是解本题关键,注意:C是单质而不是化合物,为易错点.

练习册系列答案
相关题目
12.下列叙述中,错误的是( )
| A. | 苯与浓硝酸、浓硫酸共热并保持55~60℃可反应生成硝基苯 | |
| B. | 乙苯可被酸性高锰酸钾溶液氧化为苯甲酸 | |
| C. | 甲苯与氯气在光照下发生一元取代反应,主要生成2-氯甲苯或4-氯甲苯 | |
| D. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 |
9.X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下:
(1)Q在元素周期表中的位置是第二周期VIA族.
(2)周期表中有些处于对角(左上→右下)位置的元素,它们的单质及其化合物的性质存在“对角线相似”的现象,则M的氧化物与强碱溶液反应的离子方程式是BeO+2OH-=BeO22-+H2O.
(3)Q和R按原个数比1:1组成的化合物甲是一种“绿色”氧化剂.甲中所含共价键类型是极性键、非极性键.
(4)Z与Q的最简单氢化物中沸点较高的是H2O(填化学式),原因是H2O分子之间存在氢键作用.
| 元素代号 | X | Y | Z | M | Q | R |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.037 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 | +1 |
(2)周期表中有些处于对角(左上→右下)位置的元素,它们的单质及其化合物的性质存在“对角线相似”的现象,则M的氧化物与强碱溶液反应的离子方程式是BeO+2OH-=BeO22-+H2O.
(3)Q和R按原个数比1:1组成的化合物甲是一种“绿色”氧化剂.甲中所含共价键类型是极性键、非极性键.
(4)Z与Q的最简单氢化物中沸点较高的是H2O(填化学式),原因是H2O分子之间存在氢键作用.
16.H2O、BF3 的杂化类型分别是( )
| A. | sp3、sp2 | B. | sp3、sp | C. | sp2、sp | D. | sp2、sp3 |
6.下列表示的是化学反应 A+2B═C+D 在不同条件下的反应速率,其中最快的是( )
| A. | v(A)=0.3mol?L-1?s-1 | B. | v(B)=0.5mol?L-1?s-1 | ||
| C. | v(C)=0.25mol?L-1?s-1 | D. | v(D)=0.2mol?L-1?s-1 |
13.下列描述中正确的是( )
| A. | ClO3-的空间构型为平面三角形 | |
| B. | 乙炔分子中的两个碳原子采用sp2杂化方式 | |
| C. | CS2为V形的极性分子 | |
| D. | SiF4和SO32-的中心原子均为sp3杂化 |
10.短周期元素X和Y,可组成化合物XY3.当X的原子序数为a时,Y的原子序数可能是:①a+2,②a+4,③a+8,④a+12,⑤a-6,其中正确的组合是( )
| A. | ①② | B. | ①②③ | C. | ①②③⑤ | D. | ①②④⑤ |
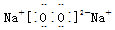 ;AB2的结构式是O=C=O.
;AB2的结构式是O=C=O.