题目内容
8.氨(NH3)、肼(N2H4)等含氮化合物在生产、生活中具有重要用途.(1)肼通常用作火箭燃料,在一定条件下可与N2O4反应生成氮气和水,肼用作火箭燃料的优点有:单位质量的燃料燃烧释放的热值高、反应产物无污染,在反应中肼作还原剂(填“氧化剂“成“还原剂”).
(2)合成氨反应是氮肥等工业的基础.己知在298℃时,氮气与氢气反应生成0.2mol 氨气放出9.22kJ的热量,请写出合成氨反应的热化学方程式:N2(g)+3H2?2NH3(g)△H=-92.2KJ/mol
(3)利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
H2O(l)═H2O(g)△H1=44.0kJ•mol1
N2(g)+O2(g)═2NO(g)△H2=229.3kJ•mol1
4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H2=-906.5kJ•mol1
4NH3(g)+6NO(g)═5N2(g)+6H2O(l)△H4
回答下列问题:
①以上四个变化过程中,发生化学键断裂的有3个.
②1molN2(g)和1mol02(g)的总能量小于(填“大于”、“小于”或“等于”)2molNO(g)的能量
③△H4=-2317kJ•mol-1.
分析 (1)肼用作火箭燃料的优点有:单位质量的燃料燃烧释放的热值高,燃烧产物几乎无污染来分析;N2H4→N2,化合价从-2→0价,化合价升高,被氧化做还原剂,据此进行分析;
(2)氮气与氢气反应生成0.2mol 氨气放出9.22kJ的热量,则生成2mol氨气放热92.2KJ,标注物质聚集状态和对应反应焓变写出合成氨反应的热化学方程式;
(3)①化学变化的本质是旧键断裂,新键形成,反应1是物理变化,其余三个是化学变化;
②N2(g)+O2(g)=2NO(g)△H2=229.3kJ•mol-1 ,△H>0故该反应为吸热反应,即反应物的总能量小于生成物的总能量,据此进行分析;
③H2O(l)=H2O(g)△H1=44.0kJ•mol-1 (i)
N2(g)+O2(g)=2NO(g)△H2=229.3kJ•mol-1 (ii)
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H3=-906.5kJ•mol-1 (iii)
由盖斯定律可知(iii)-(ii)×5-(i)×6得:4NH3(g)+6NO(g)=5N2(g)+6H2O(l),据此进行分析.
解答 解:(1)肼用作火箭燃料的优点有:单位质量的燃料燃烧释放的热值高,燃烧产物几乎无污染来分析;N2H4→N2,化合价从-2→0价,化合价升高,被氧化做还原剂,
故答案为:反应产物无污染;还原剂;
(2)氮气与氢气反应生成0.2mol 氨气放出9.22kJ的热量,则生成2mol氨气放热92.2KJ,故热化学方程式为N2(g)+3H2?2NH3(g)△H=-92.2KJ/mol,
故答案为:N2(g)+3H2?2NH3(g)△H=-92.2KJ/mol;
(3)①化学变化的本质是旧键断裂,新键形成,反应1是物理变化,其余三个是化学变化,故四个变化过程中,发生化学键断裂的有3个,
故答案为:3;
②N2(g)+O2(g)=2NO(g)△H2=229.3kJ•mol-1 ,△H>0故该反应为吸热反应,即反应物的总能量小于生成物的总能量,故1molN2(g)和1mol02(g)的总能量小于2molNO(g)的能量,
故答案为:小于;
③H2O(l)=H2O(g)△H1=44.0kJ•mol-1 (i)
N2(g)+O2(g)=2NO(g)△H2=229.3kJ•mol-1 (ii)
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H3=-906.5kJ•mol-1 (iii)
(iii)-(ii)×5-(i)×6得:4NH3(g)+6NO(g)=5N2(g)+6H2O(l),故△H4=-906.5-(229.3×5)-(44×6)=-2317kJ•mol-1,
故答案为:-2317.
点评 本题考查氧化还原反应中还原剂的判断,热化学方程式的书写,以及反应热的计算,本题难度中等.

| A. | 元素X、Z、W各自最高和最低化合价的代数和分别为1、4、6 | |
| B. | 原子半径的大小为Y>Z>W | |
| C. | 元素的非金属性顺序为W>Z>X | |
| D. | Y和其他3种元素均能形成离子化合物 |
是( )
| A. | 其单质的熔点比钠的熔点低 | B. | 其氧化物对应的水化物的碱性很强 | ||
| C. | 其原子半径在同一主族中是最大的 | D. | 在空气中燃烧只能生成Fr2O |
实验名称:卤素单质的氧化性强弱比较
实验药品:KBr溶液、KI溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸.
实验设计如下
| 实验步骤 | 实验结论 |
| ①氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、碘 |
| ②NaBr溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
| ③KI溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 |
| A. | 完成该实验需用到的实验仪器有试管和胶头滴管 | |
| B. | CCl4在实验中所起的作用是萃取剂 | |
| C. | ③中反应的离子方程式为Cl2+2I-═2Cl-+I2 | |
| D. | 上述三步实验能很好的探究卤素单质的氧化性强弱 |
| A. | 若c(Fe2+)与c(Cu2+)相等时,该反应达到平衡状态 | |
| B. | 向平衡体系中加入少量硫酸铜晶体后,FeS的KSP减小 | |
| C. | 其他条件不变,增大FeS的物质的量,该反应的正反应速率增大 | |
| D. | 该反应的化学平衡常数K=$\frac{{K}_{sp}(FeS)}{{K}_{sp}(CuS)}$ |
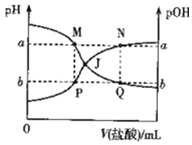
| A. | 曲线PJN表示溶液中pH的变化 | |
| B. | M点水的电离程度比Q点大 | |
| C. | M、P两点的数值之和a+b=14 | |
| D. | pH与pOH交叉点J对应的V(盐酸)=20.00 mL |
| A. | HCl | B. | MgCl2 | C. | NH4Cl | D. | NH3 |
| A. | 2,2,7,7-四甲基辛烷的一氯取代物有4种 | |
| B. | 甲醇与分子式为C3H8O的某种有机物相差2个CH2原子团,故它们一定互为同系物 | |
| C. | 苯与浓硝酸、浓硫酸共热并保持50~60℃反应生成硝基苯 | |
| D. | 甲烷和 Cl2的反应与乙烯和 Br2的反应属于同一类型的反应 |
| A. | 氯水(AgNO3溶液) | B. | NaOH溶液[Ba(OH)2溶液] | ||
| C. | FeSO4溶液(KSCN溶液) | D. | KI溶液(淀粉溶液) |