题目内容
对于可逆反应2SO2(g)+O2(g)?2SO3(g)△H<0,下列研究目的和图示相符的是( )
| A | B | C | D | |
| 研究目的 | 压强对反应的影响 | 温度对反应的影响 | 增加O2浓度对反应的影响 | 浓度对平衡常数的影响 |
| 图示 |  |  |  |  |
| A、A | B、B | C、C | D、D |
考点:化学平衡建立的过程,化学平衡的影响因素
专题:化学平衡专题
分析:A、对于可逆反应:2SO2(g)+O2(g)?2SO3(g)△H<0,应反应物气体的计量数之和大于生成物气体的化学计量数,增大压强平衡向正反应方向移动;
B、正反应为放热反应,则升高温度平衡向逆反应方向移动;
C、如只增加氧气的浓度,则正反应增大,且正反应速率大于逆反应速率,平衡向正反应方向移动;
D、平衡常数只受温度的影响,和氧气的浓度大小无关.
B、正反应为放热反应,则升高温度平衡向逆反应方向移动;
C、如只增加氧气的浓度,则正反应增大,且正反应速率大于逆反应速率,平衡向正反应方向移动;
D、平衡常数只受温度的影响,和氧气的浓度大小无关.
解答:
解:A.增大压强,反应速率增大,到达平衡所用时间较少,图象不符,故A错误;
B.正反应为放热反应,则升高温度平衡向逆反应方向移动,氧气的转化率降低,图象不符,故B错误;
C.只增加氧气的浓度,则正反应增大,且正反应速率大于逆反应速率,平衡向正反应方向移动,与图象吻合,故C正确;
D.平衡常数只受温度的影响,和氧气的浓度大小无关,图象不符,故D错误.
故选C.
B.正反应为放热反应,则升高温度平衡向逆反应方向移动,氧气的转化率降低,图象不符,故B错误;
C.只增加氧气的浓度,则正反应增大,且正反应速率大于逆反应速率,平衡向正反应方向移动,与图象吻合,故C正确;
D.平衡常数只受温度的影响,和氧气的浓度大小无关,图象不符,故D错误.
故选C.
点评:本题以图象题的形成考查外界条件对化学平衡的影响,题目难度不大,注意根据反应的化学方程式判断,为解答该题的关键.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
下列热化学方程式中,△H能正确表示物质的燃烧热的是( )
| A、2C8H18(l)+25O2(g)═16CO2(g)+18H2O(l);△H=-11036kJ/mol | ||
B、C(s)+
| ||
C、H2(g)+
| ||
D、CO(g)+
|
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、50mL 18.4mol?L-1浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA |
| B、常温常压下,4.6gNO2与N2O4混合气中含有0.3NA个原子 |
| C、1L0.1mol?L-1Na2CO3溶液中含有的阴离子数为0.1NA |
| D、标准状况下,22.4LCCl4中含有NA个分子 |
 某品牌的家用消毒剂其有效成分为对氯间二甲苯酚(结构简式如图所示),可以杀灭常见的病毒与细菌.下面有关该物质的说法正确的是( )
某品牌的家用消毒剂其有效成分为对氯间二甲苯酚(结构简式如图所示),可以杀灭常见的病毒与细菌.下面有关该物质的说法正确的是( )| A、该物质的分子式是C8H10Cl |
| B、1mol该物质最多可以与2mol氢氧化钠反应 |
| C、1mol该物质可以与2molBr2发生取代反应 |
| D、该物质可以发生加成、取代、消去、氧化等反应 |
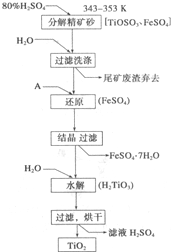 钛白粉(主要成分是Ti02),覆盖能力强,折射率高,无毒,广泛用于油漆、塑料、造纸等行业,还可用作乙醇脱水、脱氢的催化剂.如图是以钛铁矿(主要成分FeTi03,钛酸亚铁)为主要原料生产钛白粉的工艺流程图,回答下列问题:
钛白粉(主要成分是Ti02),覆盖能力强,折射率高,无毒,广泛用于油漆、塑料、造纸等行业,还可用作乙醇脱水、脱氢的催化剂.如图是以钛铁矿(主要成分FeTi03,钛酸亚铁)为主要原料生产钛白粉的工艺流程图,回答下列问题:


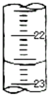 实验室用中和滴定法测定待测烧碱溶液的浓度,试根据实验回答:
实验室用中和滴定法测定待测烧碱溶液的浓度,试根据实验回答: