题目内容
12.下列物质的分子中,不含共价键的是( )| A. | MgCl2 | B. | Cl2 | C. | HCl | D. | NaOH |
分析 一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,不同非金属之间形成极性共价键,以此来解答.
解答 解:A.氯化镁只含离子键,故A选;
B.只含Cl-Cl非极性共价键,故B不选;
C.只含H-Cl极性共价键,故C不选;
D.含离子键和O-H极性共价键,故D不选;
故选A.
点评 本题考查共价键的类型及判断,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大.

练习册系列答案
相关题目
2.为清理高速公路上的积雪使用了一种融雪剂,其主要成分的化学式为XY2,X原子的结构示意图为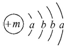 ,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
(1)m=20,该融雪剂的化学式为CaCl2.
(2)Z、W元素的名称为硫、碳.
(3)下列说法正确的是B
A.XY2和WZ2都为离子化合物 B.XY2分子中仅含离子键,WZ2中仅含共价键
C.H2Z比HY的稳定性强 D.X的阳离子比Y的阴离子半径大
(4)已知元素的电负性与元素的化合价一样,也是元素的一种基本性质.如表给出14种元素的电负性.
根据以上的数据,可推知元素的电负性具有的变化规律是在同一周期中,随着原子序数的递增,元素的电负性逐渐增大,并呈周期性变化.
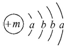 ,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.(1)m=20,该融雪剂的化学式为CaCl2.
(2)Z、W元素的名称为硫、碳.
(3)下列说法正确的是B
A.XY2和WZ2都为离子化合物 B.XY2分子中仅含离子键,WZ2中仅含共价键
C.H2Z比HY的稳定性强 D.X的阳离子比Y的阴离子半径大
(4)已知元素的电负性与元素的化合价一样,也是元素的一种基本性质.如表给出14种元素的电负性.
| 元素 | Al | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
3.下列反应中,浓硫酸既表现强氧化性,又表现酸性的是( )
| A. | 2NaCl(固体)+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2HCl↑ | |
| B. | C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O | |
| C. | Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O | |
| D. | 2FeO+4H2SO4(浓)═Fe2(SO4)3+SO2↑+4H2O |
20.下列说法正确的是( )
| A. | 在Na2CO3、NaHCO3两溶液中,离子种类不相同 | |
| B. | 在等体积、等物质的量浓度的Na2CO3、NaHCO3两溶液中,阳离子总数相等 | |
| C. | 在NaHCO3和Na2CO3混合溶液中一定有c(Na+)+c(H+)═c(HCO3-)+c(OH-)+2c(CO32-) | |
| D. | 在NaHCO3和Na2CO3混合溶液中一定有2c(Na+)=3[c(CO32-)+c(H2CO3)+c(HCO3-)] |
7.下列叙述正确的是( )
| A. | 用粗铜作电解池的阴极电解精炼铜 | |
| B. | 铅蓄电池是一种新型环保电池 | |
| C. | 氢氧燃料电池中氢气在正极上失去电子 | |
| D. | 锌锰干电池中锌发生氧化反应 |
17.下列实验事实的描述中,正确的是( )
| A. | 除去苯中的苯酚可以加入过量浓溴水后过滤 | |
| B. | 向浓硫酸中缓慢加入乙醇和冰醋酸用以制备乙酸乙酯 | |
| C. | 向2mL 10% NaOH溶液中,加入2mL 2mol/L CuSO4溶液,振荡制Cu(OH)2悬浊液,用于检验醛的性质 | |
| D. | 加入Mg(OH)2固体可除去MgCl2溶液中混有的少量FeCl3 |
1.下列物质的水溶液因水解呈酸性的是( )
| A. | KCl | B. | NaHSO4 | C. | NaHCO3 | D. | AlCl3 |
2.下列措施能使纯水中水的电离平衡向右移动的是( )
| A. | 加人少量KOH固体 | B. | 滴人少量盐酸 | ||
| C. | 加入少量硫化钠固体 | D. | 加人少量纯水 |