题目内容
20.下列说法正确的是( )| A. | 在Na2CO3、NaHCO3两溶液中,离子种类不相同 | |
| B. | 在等体积、等物质的量浓度的Na2CO3、NaHCO3两溶液中,阳离子总数相等 | |
| C. | 在NaHCO3和Na2CO3混合溶液中一定有c(Na+)+c(H+)═c(HCO3-)+c(OH-)+2c(CO32-) | |
| D. | 在NaHCO3和Na2CO3混合溶液中一定有2c(Na+)=3[c(CO32-)+c(H2CO3)+c(HCO3-)] |
分析 A.碳酸钠、碳酸氢钠溶液中含有的离子种类完全相同;
B.等体积、等浓度的碳酸钠、碳酸氢钠溶液中,碳酸钠溶液中的阳离子总数约为碳酸氢钠溶液中的2倍;
C.根据碳酸钠和碳酸氢钠溶液中的电荷守恒判断;
D.根据NaHCO3和Na2CO3混合溶液中的物料守恒分析.
解答 解:A.Na2CO3、NaHCO3两溶液中都含有Na+、H+、HCO3-、OH-、CO32-离子,含有的离子种类相同,故A错误;
B.在等体积、等物质的量浓度的Na2CO3、NaHCO3两溶液中,二者物质的量相等,两溶液中的阳离子主要为钠离子,则碳酸钠中阳离子的总物质的量约为碳酸氢钠溶液中阳离子总数的2倍,故B错误;
C.在NaHCO3和Na2CO3混合溶液中,根据电荷守恒可知:c(Na+)+c(H+)═c(HCO3-)+c(OH-)+2c(CO32-),故C正确;
D.浓度均为0.1mol•L-1的Na2CO3、NaHCO3混合溶液,假设体积为1L,则n(Na+)=0.3mol,而c(CO32-)+c(HCO3-)+c(H2CO3)=0.2mol,则:2c(Na+)=3[c(CO32-)+c(H2CO3)+c(HCO3-)],故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理的含义为解答关键,试题侧重基础知识的考查,培养了学生的分析、理解能力及灵活应用能力.

练习册系列答案
相关题目
11.下列各物质中,不能由组成它的两种元素的单质直接化合而得到的是( )
| A. | FeS | B. | Fe3O4 | C. | FeCl3 | D. | FeCl2 |
8.要将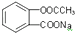 转化为
转化为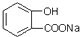 应选用的试剂和操作的是( )
应选用的试剂和操作的是( )
 转化为
转化为 应选用的试剂和操作的是( )
应选用的试剂和操作的是( )| A. | 加入足量的NaOH共热后,再通入足量的CO2 | |
| B. | 溶解,加热后通足量的CO2 | |
| C. | 与稀H2SO4共热后加足量的 NaOH | |
| D. | 与稀H2SO4共热后加足量的Na2CO3 |
5.下列元素非金属最强的是( )
| A. | S | B. | O | C. | Si | D. | P |
12.下列物质的分子中,不含共价键的是( )
| A. | MgCl2 | B. | Cl2 | C. | HCl | D. | NaOH |
9.下列粒子半径最大的是( )
| A. | Na+ | B. | Al3+ | C. | S2- | D. | Cl- |

 2C.
2C.