题目内容
10.(1)3Zn+8HNO3═3Zn(NO3)2+2H2O+4NO↑(2)3S+6KOH═2K2S+1K2SO3+3H2O.
分析 (1)反应中,Zn的化合价从0价变为+2价,化合价升高2价;硝酸中+5价N元素被还原为+2价,化合价降低3价,化合价变化的最小公倍数为6,根据化合价升降相等判断Zn、硝酸锌和NO的计量数,然后结合原子个数守恒配平方程式;
(2)反应中,硫元素从硫单质中的0价部分升高到亚硫酸钾中的+4价,部分降为硫化钾中的-2价,依据氧化还原反应得失电子守恒规律,硫化钾系数为2,亚硫酸钾系数为1,结合原子个数守恒配平方程式.
解答 解:(1)该反应中元素的化合价变化如下:Zn→Zn(NO3)2,Zn元素的化合价由0价→+2价,一个Zn失去2个电子; HNO3→NO,N元素的化合价由+5价→+2价,一个HNO3得到3个电子,所以得失电子的最小公倍数为6,所以Zn的计量数为3,Zn(NO3)2的计量数为3,NO的计量数为2,由于硝酸部分被还原,根据原子守恒,HNO3的计量数为8,H2O计量数为4,
故答案为:3;8;3;2;4
(2)反应中硫元素从硫单质中的0价部分升高到亚硫酸钾中的+4价,部分降为硫化钾中的-2价,依据氧化还原反应得失电子守恒规律,硫化钾系数为2,亚硫酸钾系数为1,依据原子个数守恒,硫单质系数为3,氢氧化钾系数为6,水系数为3,方程式为::3S+6KOH=2K2S+K2SO3+3H2O;
故答案为:3;6;2;1;3.
点评 化学方程式的配平方法有多种,如观察法、定一法、奇数配偶法、最小公倍数法等.在进行化学方程式的配平时,可以适当选择相应的方法,也可以多种方法并用,本题考查了氧化还原反应方程式的配平,根据氧化还原反应中得失电子数相等配平即可,注意还原剂部分被氧化和氧化剂部分被还原.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
1.向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L.向反应后的溶液中加入c mol/L 氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g.再将得到的沉淀灼烧至质量不再改变为止,得到固体p g.则下列关系正确的是( )
| A. | c=$\frac{b}{11.2V}$ | B. | p=m+$\frac{{V}_{c}}{125}$ | C. | n=m+17Vc | D. | $\frac{17}{9}$m<p<$\frac{5}{3}$m |
18.设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 25℃、101.3kPa时,11.2L H2中含有的原子数为NA | |
| B. | 39g Na2O2与足量水充分反应时转移的电子数为0.5NA | |
| C. | 17 g羟基与17 g氨气所含电子数均为10NA | |
| D. | 1mol/L Na2SO4溶液中离子总数为3NA |
5.下列各组溶液中的各种溶质的物质的量量浓度均为0.1mol•L-1:①H2S ②NaHS ③Na2S ④H2S 和NaHS混合液.下列说法正确的是( )
| A. | 溶液pH值从大到小的是③>②>①>④ | |
| B. | c(H2S) 从大到小是①>④>②>③ | |
| C. | 在H2S 和NaHS混合液中:2c(Na+)═c(H2S)+c(HS-)+c(S2-) | |
| D. | 在NaHS溶液中:c(H+)+c(Na+)═c(OH-)+c(HS-)+c(S2-) |
15.液氨与纯水相似,也存在着微弱的电离:2NH3?NH4++NH2-,据此判断以下叙述中错误的是( )
| A. | NH3、NH4+、NH-的电子数相等,化学性质也相同 | |
| B. | 一定温度下液氨中c(NH4+)•c(NH2-)是一个常数 | |
| C. | 液氨的电离达到平衡时c(NH3)≠c(NH4+)=c(NH2-) | |
| D. | 加入其他物质,c(NH4+)/c(NH2-)可能不变 |

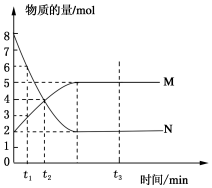 一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示: