题目内容
20.从物质A(某正盐)的水溶液出发有下面所示的一系列变化: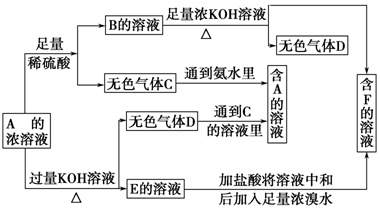
(1)写出A~F物质的化学式:
A.(NH4)2SO3;B.(NH4)2SO4;C.SO2;
D.NH3;E.K2SO3;F.K2SO4.
(2)写出E→F的化学方程式:K2SO3+Br2+H2O═K2SO4+2HBr.
(3)鉴别物质F中阴离子的方法是加盐酸、BaCl2溶液来鉴别.
分析 (1)根据框图分析知:A可跟酸反应,又可与碱反应,生成两种气体,且两种气体能反应,由C+氨水→A,D+C的溶液→A,知D为NH3,然后由D出发,结合物质的性质正反推,即可解答;
(2)根据(1)知:E为K2SO3,跟Br2发生氧化反应,生成FK2SO4,根据化学方程式即可写出化学反应方程式;
(3)F为K2SO4,阴离子为硫酸根离子,可用稀盐酸和氯化钡溶液鉴别.
解答 解:(1)根据框图分析知:A可跟酸反应,又可与碱反应,生成两种气体,且两种气体能反应,由C+氨水→A、D+C的溶液→A知D为NH3,则A为铵盐,由A可跟酸反应,又可与碱反应,A为弱酸弱碱盐,由A的溶液+浓H2SO4→B+C知B是(NH4)2SO4,推知F为K2SO4,由A的溶液+KOH→E+D可知知E为K2SO3、C为SO2、A为(NH4)2SO3,
故答案为:(NH4)2SO3;(NH4)2SO4;SO2;NH3;K2SO3;K2SO4;
(2)根据(1)知:E为K2SO3,E→F为K2SO3和Br2的反应,SO32-具有还原性,与具有氧化性的Br2发生氧化还原反应生成SO42-和Br-,反应的化学方程式为K2SO3+Br2+H2O=K2SO4+2HBr,反应的化学方程式为:K2SO3+Br2+H2O═K2SO4+2HBr,
故答案为:K2SO3+Br2+H2O═K2SO4+2HBr;
(3)F为K2SO4,阴离子为SO42-,可用BaCl2检验SO42-,取少量F的溶液加入BaCl2和盐酸的溶液,若产生白色沉淀,证明SO42-的存在,
故答案为:加盐酸、BaCl2溶液来鉴别.
点评 本题考查无机推断,题目难度中等,A可跟酸反应又可与碱反应为突破口,明确常见元素及其化合物性质为解答关键,试题有利于提高学生的分析、理解能力及逻辑推理能力.

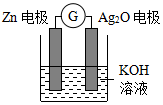 银锌电池是一种常见化学电源,其原理反应:Zn+Ag2O+H2O═Zn(OH)2+2Ag,其工作示意图如图.下列说法不正确的是( )
银锌电池是一种常见化学电源,其原理反应:Zn+Ag2O+H2O═Zn(OH)2+2Ag,其工作示意图如图.下列说法不正确的是( )| A. | Zn电极是负极 | |
| B. | Ag2O电极上发生还原反应 | |
| C. | Zn电极的电极反应式:Zn-2e-+2OH-═Zn(OH)2 | |
| D. | 放电前后电解质溶液的pH保持不变 |
| A. | 酸式盐 | B. | 含氧酸盐 | C. | 钠盐 | D. | 无氧酸盐 |
| A. | 1mol | B. | 2 mol | C. | 3mol | D. | 4mol |
| A. | 在反应 KClO3+6HCl═KCl+3Cl2↑+3H2O 中,Cl2既是氧化产物又是还原产物,当得到标准状况下的 67.2 L Cl2 时,反应中转移的电子数为 5NA | |
| B. | 标准状况下,22.4 L 甲苯中含有的 C-H 键数目为 8NA | |
| C. | 50 g 46%的乙醇水溶液中,含氢原子总数目为 3NA | |
| D. | t℃时,MgCO3的 Ksp=4×10-6,则该温度下饱和 MgCO3溶液中含有的 Mg2+数目为 2×10-3 NA |
| A. | “光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关 | |
| B. | Al(OH)3可作阻燃剂,因此可以用于灭火 | |
| C. | SiO2可用于制造光导纤维,其性质稳定,不溶于强酸、强碱 | |
| D. | 焰火的五彩缤纷是某些金属元素的性质的展现 |