题目内容
某学生用12mol?L-1的浓盐酸制0.10mol?L-1的稀盐酸500ml.回答下列问题:
(1)量取浓盐酸的体积为 ml,应选用的量筒规格为 .
(2)配制时应选用的容量瓶规格为 .
(3)配制时(除容量瓶外)还需选用的仪器主要有 、 、 、 和试剂瓶.
(1)量取浓盐酸的体积为
(2)配制时应选用的容量瓶规格为
(3)配制时(除容量瓶外)还需选用的仪器主要有
考点:溶液的配制
专题:实验题
分析:设量取浓盐酸的体积是V.根据稀释前后HCl物质的量守恒建立关系式求得浓盐酸的体积;根据稀盐酸的体积来选取容量瓶的规格;结合配置步骤选取仪器.
解答:
解:(1)设量取浓盐酸的体积是V.根据题意,得12V=0.10×0.5,解得V=4.2(mL),
由于没有此种规格的容量瓶,所以用10mL的容量瓶;
故答案为:4.2、10mL;
(2)因为要制取500mL稀盐酸,所以选用500mL的容量瓶;故答案为:500mL;
(3)配置一定质量分数的溶液,一般要经过计算、量取(使用量筒量取、胶头滴管)、稀释(在烧杯中稀释、玻璃棒搅拌均匀)、转移到容量瓶中定容;
故答案为:烧杯;量筒;玻璃棒;胶头滴管.
由于没有此种规格的容量瓶,所以用10mL的容量瓶;
故答案为:4.2、10mL;
(2)因为要制取500mL稀盐酸,所以选用500mL的容量瓶;故答案为:500mL;
(3)配置一定质量分数的溶液,一般要经过计算、量取(使用量筒量取、胶头滴管)、稀释(在烧杯中稀释、玻璃棒搅拌均匀)、转移到容量瓶中定容;
故答案为:烧杯;量筒;玻璃棒;胶头滴管.
点评:本题主要考查了一定质量分数的溶液的配置、有关溶质质量分数的简单计算.配制一定质量分数的溶液,是考查的热点.操作步骤、实验仪器、配制方案的设计、实验过程中的误差分析,都将是考查的重点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
短周期元素X、Y、Z和W的原子序数依次递增,且在同一周期,四种元素原子的最外层电子数之和为19,X和Y元素原子的原子序数比 6:7,X的最高正价是W的最低负价的绝对值的2倍.下列说法正确的是( )
| A、X离子的半径比Z离子的半径大 |
| B、Y的氧化物是良好的半导体材料 |
| C、Z的氢化物比W的氢化物的还原性更强 |
| D、X和W的化合物中含有共价键和离子键 |
下列叙述正确的是( )
| A、向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成 |
| B、为验证NaHCO3固体中是否含有Na2CO3,将样品溶于水后加BaCl2溶液,看有无沉淀产生 |
| C、等质量的Na2CO3、NaHCO3分别与足量的同浓度盐酸反应,NaHCO3消耗的盐酸多 |
| D、Na2CO3和NaHCO3都既能与酸反应,又能与氢氧化钡反应 |
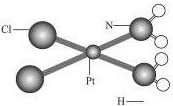 顺铂[化学名称为顺二氯二氨合铂(Ⅱ),化学式为PtCl2(NH3)2]是一种用于治疗癌症的药物,它的分子结构可用如图表示,一片顺铂药片所含顺铂的质量为0.3mg,那么:
顺铂[化学名称为顺二氯二氨合铂(Ⅱ),化学式为PtCl2(NH3)2]是一种用于治疗癌症的药物,它的分子结构可用如图表示,一片顺铂药片所含顺铂的质量为0.3mg,那么: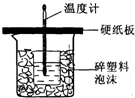 50mL 0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算反应热.请回答下列问题:
50mL 0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算反应热.请回答下列问题: