题目内容
下列叙述正确的是( )
| A、向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成 |
| B、为验证NaHCO3固体中是否含有Na2CO3,将样品溶于水后加BaCl2溶液,看有无沉淀产生 |
| C、等质量的Na2CO3、NaHCO3分别与足量的同浓度盐酸反应,NaHCO3消耗的盐酸多 |
| D、Na2CO3和NaHCO3都既能与酸反应,又能与氢氧化钡反应 |
考点:钠的重要化合物
专题:几种重要的金属及其化合物
分析:A.碳酸氢钠和碳酸氢钙不反应;
B.氯化钡和碳酸氢钠不反应、和碳酸钠反应生成白色沉淀;
C.Na2CO3+2HCl=2NaCl+CO2↑+H2O、NaHCO3+HCl=NaCl+H2O+CO2↑,根据方程式计算;
D.碳酸钠和碳酸氢钠都属于弱酸盐,所以都能和强酸反应,都能和氢氧化钡反应生成碳酸钡白色沉淀.
B.氯化钡和碳酸氢钠不反应、和碳酸钠反应生成白色沉淀;
C.Na2CO3+2HCl=2NaCl+CO2↑+H2O、NaHCO3+HCl=NaCl+H2O+CO2↑,根据方程式计算;
D.碳酸钠和碳酸氢钠都属于弱酸盐,所以都能和强酸反应,都能和氢氧化钡反应生成碳酸钡白色沉淀.
解答:
解:A.CaCO3沉淀的水中通入CO2至沉淀恰好溶解,生成碳酸氢钙溶液,再加入NaHCO3饱和溶液,碳酸氢钙与碳酸氢钠不发生反应,不能生成碳酸钙沉淀,故A错误;
B.氯化钡和碳酸氢钠不反应、和碳酸钠反应生成白色沉淀,所以能用氯化钡溶液鉴别碳酸氢钠和碳酸钠溶液,故B正确;
C.Na2CO3+2HCl=2NaCl+CO2↑+H2O、2NaHCO3+2HCl=2NaCl+2H2O+2CO2↑,根据方程式知,消耗2molHCl时,需要碳酸钠、碳酸氢钠的质量分别为106g、168g,所以等质量的Na2CO3、NaHCO3分别与足量的同浓度盐酸反应,Na2CO3消耗的盐酸多,故C错误;
D.Na2CO3+2HCl=2NaCl+CO2↑+H2O、NaHCO3+HCl=NaCl+H2O+CO2↑、Na2CO3+Ba(OH)2=BaCO3↓+2NaOH、NaHCO3+Ba(OH)2=BaCO3↓+NaOH+H2O,所以Na2CO3和NaHCO3都既能与酸反应,又能与氢氧化钡反应,故D正确;
故选BD.
B.氯化钡和碳酸氢钠不反应、和碳酸钠反应生成白色沉淀,所以能用氯化钡溶液鉴别碳酸氢钠和碳酸钠溶液,故B正确;
C.Na2CO3+2HCl=2NaCl+CO2↑+H2O、2NaHCO3+2HCl=2NaCl+2H2O+2CO2↑,根据方程式知,消耗2molHCl时,需要碳酸钠、碳酸氢钠的质量分别为106g、168g,所以等质量的Na2CO3、NaHCO3分别与足量的同浓度盐酸反应,Na2CO3消耗的盐酸多,故C错误;
D.Na2CO3+2HCl=2NaCl+CO2↑+H2O、NaHCO3+HCl=NaCl+H2O+CO2↑、Na2CO3+Ba(OH)2=BaCO3↓+2NaOH、NaHCO3+Ba(OH)2=BaCO3↓+NaOH+H2O,所以Na2CO3和NaHCO3都既能与酸反应,又能与氢氧化钡反应,故D正确;
故选BD.
点评:本题考查了钠的化合物,明确物质的性质是解本题关键,注意碳酸钠和碳酸氢钠分别和稀盐酸反应现象的区别,碳酸钠和盐酸反应先生成碳酸氢钠,碳酸氢钠再和盐酸反应生成二氧化碳.

练习册系列答案
相关题目
鲨鱼是世界上惟一不患癌症的动物,科学研究表明,鲨鱼体内含有一种角鲨烯,具有抗癌性.实验测得角鲨烯分子是链状结构,分子中含有30个碳原子且碳氢质量比为7.2:1,下列说法不正确的是( )
| A、角鲨烯分子式为C30H50 |
| B、1mol角鲨烯最多可与6mol溴单质加成 |
| C、角鲨烯与分子式为C29H48的物质可能属于同系物 |
| D、角鲨烯是高分子化合物 |
下列化学方程式中,不能用离子方程式Ba2++SO42-═BaSO4 表示的是( )
| A、BaCl2+K2SO4═BaSO4+2 KCl |
| B、Ba(OH)2+K2SO4═BaSO4+2 KOH |
| C、Ba(NO3)2+H2SO4═BaSO4+2 HNO3 |
| D、Ba(OH)2+H2SO4═BaSO4+2 H2O |
实验室中需要配制2mol/L的NaCl溶液950mL,配制时应称取的NaCl的质量是( )
| A、111.2g |
| B、1112.0g |
| C、117.0g |
| D、1170.0g |
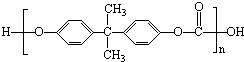 2010年5月1日上海世博会隆重开幕,世博会的环保概念是人们关心的话题,环保材料更为世人瞩目,其中聚碳酸酯是用得较多的材料.聚碳酸酯的结构简式如图所示,下列说法正确的是( )
2010年5月1日上海世博会隆重开幕,世博会的环保概念是人们关心的话题,环保材料更为世人瞩目,其中聚碳酸酯是用得较多的材料.聚碳酸酯的结构简式如图所示,下列说法正确的是( )| A、它在结构上可以看成由碳酸和另一有机物通过缩聚反应而成 |
| B、该有机物是一种高分子化合物,肯定易溶于水 |
| C、它是一种纯净物,属于酯类物质 |
| D、它耐强酸,强碱,不可与强氧化剂发生反应 |
有关化学用语正确的是( )
| A、苯的结构简式C6H6 |
| B、乙烯的结构简式CH2CH2 |
C、四氯化碳的电子式 |
| D、乙酸的分子式C2H4O2 |
下列物质中含有非极性键且为盐的是( )
| A、CH3COONa |
| B、NH4Cl |
| C、CaCl2 |
| D、H2O2 |
下列各组物质的熔点变化规律,与它们的化学键无关的是( )
| A、F2、Cl2、Br2、I2的熔点依次升高 |
| B、Li、Na、K、Rb的熔点依次降低 |
| C、NaF、NaCl、NaBr、NaI的熔点依次降低 |
| D、晶体硅、碳化硅、金刚石熔点依次升高 |