题目内容
15.下列各组物质中,所含化学键(离子键、共价键)类型完全相同的是( )| A. | H2O2、K2O2、C2H2 | B. | CaC12、BaO2、MgF2 | ||
| C. | CO2、CS2、KO2 | D. | NH4Cl、NaOH、KHS04 |
分析 一般来说,活泼金属与活泼非金属形成离子键,非金属元素之间形成共价键,以此来解答.
解答 解:A.K2O2中既含离子键又含非极性共价键,C2H2、H2O2中含共价键,化学键类型不同,故A错误;
B.CaC12、MgF2中只含有离子键,BaO2中含有离子键和非极性共价键,类型不相同,故B错误;
C.CO2、CS2中含共价键,KO2中含有离子键,类型不相同,故C错误;
D.NH4Cl、NaOH、KHS04都为离子化合物,都含有离子键和共价键,故D正确.
故D.
点评 本题考查化学键的判断,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,注意特殊物质中的化学键,题目难度不大.

练习册系列答案
相关题目
6.下列不属于有机物的是( )
| A. |  | B. | S=C=S | C. | CCl4 | D. | HCOOH |
3.下列说法正确的是( )
| A. | 沸点由高到低:癸烷、正已烷、新戊烷、正戊烷 | |
| B. | 酸性高锰酸钾溶液既可以鉴别甲烷和乙烯,又可以用来除去甲烷中的少量乙烯 | |
| C. | 乙烯的化学性质比乙烷活泼,可作香蕉等水果的催熟剂 | |
| D. | 苯可以通过石油分馏或煤焦油的催化重整获得 |
10.下列各组混合物,不能用分液漏斗分开的是( )
①CCl4和水②乙醇和甘油③乙醛和水④苯和水⑤己烷和水⑥环己烷和苯⑦溴苯和水.
①CCl4和水②乙醇和甘油③乙醛和水④苯和水⑤己烷和水⑥环己烷和苯⑦溴苯和水.
| A. | ①②③ | B. | ②③⑥ | C. | ①④⑤⑦ | D. | ④⑤⑥ |
7.已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中A原于核外有三个未成对电子;化合物B2E为离子晶体,E原子核外的M层中只有两对成对电子;C元素的电离能数据如下表; D元素的电负性是同周期元素中最大的; F原子最外层电子数与B的相同,其余各层均充满电子.
请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
(1)B和D形成的化合物的熔点比C和D形成的化合物的熔点高(填“高”或“低”),理由是NaCl为离子晶体而AlCl3为分子晶体;冶炼C单质时加入的降低熔点的物质中含有的化学键类型有离子键、共价键、配位键(填“离子键”或“共价键”或“配位键”)
(2)E的价电子排布图为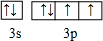 ,E的最高价氧化物对应的水化物的浓溶液与F的单质反应的化学方程式为S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O.
,E的最高价氧化物对应的水化物的浓溶液与F的单质反应的化学方程式为S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O.
(3)碳元素与E形成的化合物是极性键形成的非极性分子(填“极性”或“非极性”);其中碳原子的杂化方式为sp,该分子中含有σ键和π键的数目之比为1:1.
(4)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,则其化学式为AlN,其晶体中所含的化学键类型为共价键.
| 各级电离能 | 电离能数值kJ/mol |
| 第一电离能 | 578 |
| 第二电离能 | 1817 |
| 第三电离能 | 2745 |
| 第四电离能 | 11575 |
| 第五电离能 | 14830 |
| 第六电离能 | 18376 |
(1)B和D形成的化合物的熔点比C和D形成的化合物的熔点高(填“高”或“低”),理由是NaCl为离子晶体而AlCl3为分子晶体;冶炼C单质时加入的降低熔点的物质中含有的化学键类型有离子键、共价键、配位键(填“离子键”或“共价键”或“配位键”)
(2)E的价电子排布图为
 ,E的最高价氧化物对应的水化物的浓溶液与F的单质反应的化学方程式为S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O.
,E的最高价氧化物对应的水化物的浓溶液与F的单质反应的化学方程式为S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O.(3)碳元素与E形成的化合物是极性键形成的非极性分子(填“极性”或“非极性”);其中碳原子的杂化方式为sp,该分子中含有σ键和π键的数目之比为1:1.
(4)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,则其化学式为AlN,其晶体中所含的化学键类型为共价键.
4.下列晶体的空间构型属于直线型的是( )
| A. | H2O | B. | CO2 | C. | NH3 | D. | H2O2 |
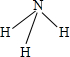 ,它的共价键属于极性(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为
,它的共价键属于极性(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为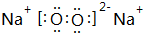 .
.