题目内容
4.在一密闭容器中进行如下反应:3H2(气)+N2(气)?2NH3(气),已知反应过程中某一时 刻 H2、N2、NH3 的浓度分别为 0.3mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )| A. | H2 为 0.6mol/L、N2 为 0.2mol/L | B. | NH3为 0.25mol/L | ||
| C. | N2、NH3 均为 0.15mol/L | D. | NH3为 0.4mol/L |
分析 化学平衡研究的对象为可逆反应.化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值.
解答 解:反应N2(g)+3H2(g)?2NH3(g)为可逆反应,转化率不可能为100%,根据化学计量数及极值法考虑:N2的范围在(0,0.2),H2的范围在(0,0.6),而NH3可以(0,0.4),
A、氨气不可能完全转化,所以氮气浓度小于0.2 mol/L,氢气浓度小于0.6mol/L,故A错误;
B、氨气的浓度范围为:(0,0.4),氮气和氢气不可能完全转化生成氨气,故B正确;
C、氮气的浓度范围为(0,0.2),氮气为0.15mol/L在该范围内,氨气的浓度范围为:(0,0.4),但是NH3 为 0.15mol/L,消耗0.05mol/L,不会产生氮气0.05mol/L,故C错误;
D、氨气的浓度范围为:(0,0.4),氮气和氢气不可能完全转化生成氨气,所以氨气不可能为0.4mol/L,故D错误;
故选B.
点评 本题考查了可逆反应的特点,题目难度不大,转移明确可逆反应中反应物转化率不可能为100%,该题是高考中的常见题型,注重基础,侧重考查学生分析问题、解决问题的能力.

练习册系列答案
相关题目
14.同温同压下两个体积相同的容器,一个盛NH3气体,另一个盛N2和H2的混合气体,两瓶气体一定有相同的是( )
| A. | 质量 | B. | 原子总数 | C. | 密度 | D. | 分子总数 |
15.空气负离子[O2-(H2O)n]-对人体健康有着重要的生理意义,被誉为“空气维生素”,人吸入一定量的空气负离子,会减少某些疾病的发生.而“空调综合征”与室内缺少空气负离子有关.下列有关空气负离子的说法不正确的是( )
| A. | 具有很强的生物活性 | B. | 是一种十分稳定的化合物 | ||
| C. | 能增强人体抗病能力 | D. | 具有除尘、除臭和杀菌等作用 |
12.胶体区别于其它分散系的本质是( )
| A. | 胶体是一种混合物 | B. | 胶体粒子有颜色 | ||
| C. | 胶体粒子直径在1-100nm之间 | D. | 光束通过胶体时有丁达尔效应 |
19.运用相关化学知识进行判断,下列结论错误的是( )
| A. | 某吸热反应能自发进行,因此该反应是熵增反应 | |
| B. | NH4F 水溶液中含有 HF,因此 NH4F 溶液不能存放于玻璃试剂瓶中 | |
| C. | 可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 | |
| D. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成 H2 的速率 |
16.下列属于氧化还原反应的是( )
| A. | CuO+2HCl═CuCl2+H2O | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | Zn+CuSO4═ZnSO4+Cu | D. | Ca(OH)2+CO2═CaCO3↓+H2O |
16.下列实验所用试剂、现象和结论均正确的是( )
| 序号 | 实验内容 | 试剂 | 现象和结论 |
| ① | 鉴别K2CO3和Na2SO3 | 盐酸、澄清的石灰水 | 产生无色无味气体,能使澄清的石灰水变浑浊的是K2CO3 |
| ② | 鉴别NO2和Br2蒸气 | 湿润的淀粉KI试纸 | 试纸变蓝色的是Br2蒸气 |
| ③ | 除去氯化钙溶液中的氯化铁杂质 | 碳酸钙 | 调节溶液的pH为3.7,再过滤 |
| A. | ①②③ | B. | ③ | C. | ①② | D. | ①③ |
17.25°C时某些弱酸的电离平衡常数Ka如下表,下列说法正确的是( )
| 化学式 | CH3COOH | HClO | H2CO3 |
| Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同pH的三种酸溶液,物质的量浓度由大到小的顺序为:c(HClO)>c(CH3COOH)>c(H2CO3) | |
| B. | 在相同物质的量浓度的Na2CO3、NaClO、NaHCO3与CH3COONa四种钠盐中加水稀释,水解程度均增大,碱性均增强 | |
| C. | 等物质的量浓度的NaClO和NaHCO3 混合溶液中:c(Na+)=c(HClO)+c(ClO-)+c(HCO3-)+c(CO32-)+c(H2CO3) | |
| D. | 向次氯酸钠溶液中通入少量二氧化碳气体的离子方程式为:2ClO-+CO2+H2O═CO32-+2HClO |
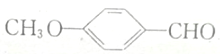 的同分异构体,符合下列条件,写出H的结构简式:
的同分异构体,符合下列条件,写出H的结构简式: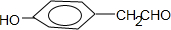 .
.