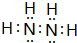题目内容
17.25°C时某些弱酸的电离平衡常数Ka如下表,下列说法正确的是( )| 化学式 | CH3COOH | HClO | H2CO3 |
| Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同pH的三种酸溶液,物质的量浓度由大到小的顺序为:c(HClO)>c(CH3COOH)>c(H2CO3) | |
| B. | 在相同物质的量浓度的Na2CO3、NaClO、NaHCO3与CH3COONa四种钠盐中加水稀释,水解程度均增大,碱性均增强 | |
| C. | 等物质的量浓度的NaClO和NaHCO3 混合溶液中:c(Na+)=c(HClO)+c(ClO-)+c(HCO3-)+c(CO32-)+c(H2CO3) | |
| D. | 向次氯酸钠溶液中通入少量二氧化碳气体的离子方程式为:2ClO-+CO2+H2O═CO32-+2HClO |
分析 A.酸的电离常数越大,其酸性越强;
B.水解程度增大,但是溶液中氢氧根离子浓度减小,溶液的碱性均减弱;
C.根据Cl原子与C原子相等,结合溶液中物料守恒分析;
D.次氯酸的酸性大于碳酸氢根离子,根据强酸制取弱酸判断.
解答 解:A.酸的电离常数越大,其酸性越强,所以等物质的量浓度溶液酸性由强到弱的顺序为:CH3COOH>H2CO3>HClO,故A错误;
B.稀释过程中酸根离子的水解程度都增大,但是溶液中氢氧根离子的浓度都减小,则溶液的碱性都减弱,故B错误;
C.等物质的量浓度的NaClO和NaHCO3混合溶液中,Cl原子与C原子相等,由溶液中物料守恒可知:c(HClO)+c(ClO-)=c(HCO3-)+c(CO32-)+c(H2CO3)=c(Na+),则:c(Na+)=c(HClO)+c(ClO-)+c(HCO3-)+c(CO32-)+c(H2CO3),故C正确;
D.碳酸的二级电离小于次氯酸,所以碳酸氢根离子的酸性小于次氯酸,则向NaClO溶液中通入少量二氧化碳的离子方程式为:ClO-+CO2+H2O═HClO+HCO3-,故D错误;
故选C.
点评 本题考查离子浓度大小比较,题目难度中等,明确酸的电离常数与酸的强弱、酸根离子水解能力的关系是解本题关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.在一密闭容器中进行如下反应:3H2(气)+N2(气)?2NH3(气),已知反应过程中某一时 刻 H2、N2、NH3 的浓度分别为 0.3mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
| A. | H2 为 0.6mol/L、N2 为 0.2mol/L | B. | NH3为 0.25mol/L | ||
| C. | N2、NH3 均为 0.15mol/L | D. | NH3为 0.4mol/L |
5.下列有关物质性质或用途的说法不正确的是( )
| A. | 乙醇能够使蛋白质变性,75%(体积分数)的乙醇溶液可用于医疗消毒 | |
| B. | 乙二醇的水溶液凝固点很低,可用作汽车发动机的抗冻剂 | |
| C. | 光照时乙烷与氯气能发生取代反应,工业上常用该反应生产氯乙烷 | |
| D. | 油脂的碱性水解又称为皂化,其产物之一高级脂肪酸盐可用于制造肥皂 |
12.某小组为研究电化学原理,设计甲、乙、丙三种装置(C1、C2、C3均为石墨).下列叙述正确的是( )
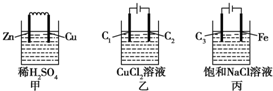

| A. | 甲、丙中是化学能转变为电能,乙中是电能转变为化学能 | |
| B. | C1、C2分别是阳极、阴极,锌片、铁片上都发生氧化反应 | |
| C. | C1上和C3上放出的气体相同,铜片上和铁片上放出的气体也相同 | |
| D. | 甲、乙、丙中溶液的pH都逐渐升高 |
9.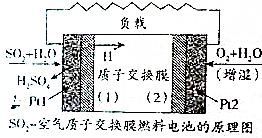 二氧化硫、空气质子交换膜电池将化学能默认变成电能的同时,实现了制硫酸、发电、环保三位一体的结合,降低了成本提高了效益,其原理如图所示,下列说法错误的是( )
二氧化硫、空气质子交换膜电池将化学能默认变成电能的同时,实现了制硫酸、发电、环保三位一体的结合,降低了成本提高了效益,其原理如图所示,下列说法错误的是( )
 二氧化硫、空气质子交换膜电池将化学能默认变成电能的同时,实现了制硫酸、发电、环保三位一体的结合,降低了成本提高了效益,其原理如图所示,下列说法错误的是( )
二氧化硫、空气质子交换膜电池将化学能默认变成电能的同时,实现了制硫酸、发电、环保三位一体的结合,降低了成本提高了效益,其原理如图所示,下列说法错误的是( )| A. | Pt1电极附近发生的反应为SO2+2H2O-2e-═SO42-+4H+ | |
| B. | Pt2电极附近发生的反应为O2+4e-═2O2- | |
| C. | 该电池放电时电子从Pt1电极经过外电路流到Pt2电极 | |
| D. | 相同条件下,放电过程中消耗的SO2和O2的体积之比为2:1 |
7.如图所示是“能源相关图”,下列四组能源选项中全部符合图中阴影部分能源的是( )


| A. | 煤炭、石油、沼气 | B. | 风能、太阳能、沼气 | ||
| C. | 地热能、海洋能、核能 | D. | 生物质能、天然气、水能 |
 ,
,