题目内容
19.关于碱金属元素的下列叙述中,错误的是( )| A. | 碱金属元素原子最外层都只有1个电子 | |
| B. | 依Li、Na、K、Rb、Cs,单质熔沸点升高,密度增大 | |
| C. | 随核电荷数递增,氢氧化物碱性增强 | |
| D. | 随电子层数增加,原子半径增大,金属还原性和金属性增强 |
分析 A.碱金属元素的原子最外层都只有一个电子;
B.随核电荷数递增,单质的熔沸点随着核电荷数的增大而减小,碱金属单质的密度逐渐增大;
C.金属性越强,氢氧化物的碱性越强;
D.随电子层数增加,原子半径增大,碱金属元素的失电子能力增强.
解答 解:A.碱金属元素在周期表中位于第IA族,碱金属元素原子最外层都只有一个电子,故A正确;
B.碱金属都属于金属晶体,金属阳离子半径增大,对外层电子束缚能力减弱,金属键减弱,所以熔沸点降低,碱金属单质的密度逐渐增大,故B错误;
C.金属性越强,氢氧化物的碱性越强,所以随核电荷数递增,氢氧化物碱性增强,故C正确;
D.随电子层数增加,原子半径增大,碱金属元素的失电子能力增强,则金属还原性和金属性增强,故D正确.
故选B.
点评 本题考查碱金属族元素性质递变规律,以碱金属族、卤族元素为例熟记同一主族元素性质递变规律,知道规律中的异常现象,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.短周期元素a、b、c、d的原子序数依次增大.c、a、b最外层电子数为等差数列.公差为2.a、c的价电子数之和为6.d的核外电子数等于b的核外电子数加8.下列叙述错误的是( )
| A. | a和b可形成气态化合物 | |
| B. | c的原子半径小于d的原子半径 | |
| C. | b和c形成的化合物为离子化合物 | |
| D. | a和d最高价氧化物的水化物均呈酸性 |
10.室温下,下列叙述正确的是( )
| A. | pH=2的HA酸溶液与pH=12的MOH碱溶液以任意比混合:c(OH-)+c(M+)=c(H+)+c(A-) | |
| B. | 将物质的量浓度均为0.1mol•L-1的Na2CO3溶液和NaHCO3溶液等体积混合所得溶液中:2c(OH-)-2c(H+)=3c(H2CO3)+c(HCO${\;}_{3}^{-}$)-c(CO${\;}_{3}^{2-}$) | |
| C. | 等浓度、等体枳的Na2CO3和NaHCO3混合:$\frac{c(HC{O}_{3}^{-})}{c({H}_{2}C{O}_{3})}$<$\frac{c(C{O}_{3}^{2-})}{c(HC{O}_{3}^{-})}$ | |
| D. | 将足量AgCl分别放入:①5mL水,②10mL0.2mol/LMgCl2,③20mL0.3mol/L盐酸中溶解至饱和,c(Ag+):①>②>③ |
7. 用0.1mol•L-1NaOH溶液滴定10mL0.1mol•L-1H2A溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列说法错误的是( )
用0.1mol•L-1NaOH溶液滴定10mL0.1mol•L-1H2A溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列说法错误的是( )
 用0.1mol•L-1NaOH溶液滴定10mL0.1mol•L-1H2A溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列说法错误的是( )
用0.1mol•L-1NaOH溶液滴定10mL0.1mol•L-1H2A溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列说法错误的是( )| A. | A点溶液中加入少量水:$\frac{c(O{H}^{-})}{c({H}_{2}A)}$增大 | |
| B. | B点:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| C. | C点:c(Na+)=c(HA-)+2c(OH-) | |
| D. | 水电离出来得c(OH-):B>D |
14.把0.05molNaOH固体分别加入到100mL下列液体中,溶液的导电能力变化最小的是( )
| A. | 0.5mol/L KCl溶液 | B. | 自来水 | ||
| C. | 0.5mol/L盐酸 | D. | 0.5mol/L醋酸溶液 |
4.常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1的CH3COOH溶液和HCN溶液,滴定曲线如图所示.下列说法不正确的是( )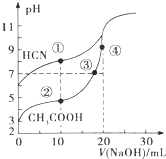

| A. | 点③溶液中,c(OH-)=c(H+)+c(CH3COOH) | |
| B. | 点①溶液的c(CN-)<点②溶液的c(CH3COO-) | |
| C. | 点④溶液中,c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 在点②和③之间(不包括端点)存在离子浓度大小关系:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |

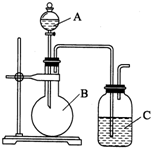 某同学设计如图装置,探究非金属性质变化规律.
某同学设计如图装置,探究非金属性质变化规律.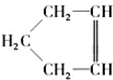 ,可简写为
,可简写为 ,降冰片烯的分子结构可表示为
,降冰片烯的分子结构可表示为 .
. .(任选一种)
.(任选一种)