题目内容
7.氨在国民生产中占有重要的地位.工业合成氨的反应为:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol.请回答下列问题:(1)表明合成氨反应处于平衡状态的是cd(填字母)
a.2v正(NH3)>3v逆(H2)b.c(N2)=c(H2)>c(NH3)
c.单位时间内有3molH-H键断裂,同时有6molN-H键断裂
d.恒温恒容时,容器内压强不变
e.恒温恒容时,容器内混合气体的弥补不变
(2)在一定条件下的密闭容器中,该反应达到平衡,既要加快反应速率,又要提高H2的转化率,可以采取的措施有c(填字母)
a.升高温度 b.分离出液态氨气 c.增加N2浓度 d.增加H2浓度
(3)已知在400℃时,N2(g)+3H2(g)?2NH3(g)的平衡常数K=0.5,则NH3(g)?N2(g)+3H2(g)的平衡常数表达式为K=$\frac{c({N}_{2})•{c}^{3}({H}_{2})}{{c}^{2}(N{H}_{3})}$,数值为2.
(4)有两个密闭容器A和B,A容器保持恒容,B容器爆出恒压,起始时向容积相等的A、B中分别通入等量的NH3气体,均发生反应:2NH3(g)?3H2(g)+N2(g).则:
①达到平衡所需的时间:t(A)<t(B),平衡时,NH3的转化率:a(A)<a(B) (填“>”、“=”或“<”).
②达到平衡后,在两容器中分别通入等量的氦气.A中平衡向不移动,B中平衡向向正反应方向移动.(填“向正反应方向”、“向逆反应方向”、“不”).
(5)在三个相同容器中各充入1molN2和3molH2,在不同条件下反应并达到平衡,氨的体积分数[Ψ(NH3)]随时间变化的曲线如图所示.下列说法中正确的是b(填字母,下同).

a.图Ⅰ可能是不同压强对反应的影响,且p2>p1
b.图Ⅱ可能是同温同压下不同催化剂对反应的影响,且催化剂性能1>2
c.图Ⅲ可能是不同温度对反应的影响,且T1>T2.
分析 (1)达平衡时各组分的物质的量不随时间的变化,说明达平衡状态;
(2)a.升高温度,反应速率加快,但平衡逆向移动;
b.分离出液态氨气,反应速率减小,平衡正向移动;
c.增加N2浓度,反应速率加快,平衡正向移动;
d.增加H2浓度,反应速率加快,但氢气的转化率减小;
(3)N2(g)+3H2(g)?2NH3(g)的K′=0.5,则2NH3(g)?N2(g)+3H2(g)的K=$\frac{1}{{K}^{′}}$=2;
(4)①根据压强大小,判断速率大小;根据压强对平衡的影响分析
②达到平衡后,在两容器中分别通入等量的氦气,A体积不变,B体积膨胀,根据反应物浓度变化分析;
(5)a.增大压强平衡右移;
b.催化剂不影响平衡移动;
c.升高温度平衡逆向移动.
解答 解:(1)a.2v正(NH3)>3v逆(H2),正逆反应速率不变,所以不可能达平衡状态,故错误;
b.c(N2)=c(H2)>c(NH3),未体现正与逆的关系,故错误;
c.单位时间内有3molH-H键断裂等效于6molN-H键形成,同时有6molN-H键断裂,正逆反应速率相等,反应达平衡状态,故正确;
d.恒温恒容时,容器内压强不变,说明气体的物质的量不变,反应达平衡状态,故正确;
e.恒温恒容时,容器内混合气体的弥补不变,说明反应未达平衡状态,故错误;
故选:cd;
(2)a.升高温度,反应速率加快,但平衡逆向移动,氮气的转化率减小,故错误;
b.分离出液态氨气,反应速率减小,平衡正向移动,故错误;
c.增加N2浓度,反应速率加快,平衡正向移动,氢气的转化率增大,故正确;
d.增加H2浓度,反应速率加快,但氢气的转化率减小,故错误;
故选:c;
(3)N2(g)+3H2(g)?2NH3(g)的K′=0.5,则2NH3(g)?N2(g)+3H2(g),平衡常数表达式为:K=$\frac{c({N}_{2})•{c}^{3}({H}_{2})}{{c}^{2}(N{H}_{3})}$;K=$\frac{1}{{K}^{′}}$=2,故答案为:$\frac{c({N}_{2})•{c}^{3}({H}_{2})}{{c}^{2}(N{H}_{3})}$;2;
(4)①A容器能保持恒容,则反应后压强增大,B容器能保持恒压,所以A中的压强大于B,压强越大,反应速率越快,所用时间越短,则所用时间A小于B;压强增大平衡向逆反应方向移动,所以压强越大,转化率越小,A的压强大,则A的转化率小于B;故答案为:<;<;
②达到平衡后,在两容器中分别通入等量的氦气,A体积不变,B体积膨胀,则A中各反应物质的浓度不变,A中反应速率不变,B中各反应物浓度减小,各反应物所占的压强减小,平衡正移;
故答案为:不;向正反应方向;
(5)a.增大压强平衡右移,氨气的含量应增大,故错误;
b.催化剂不影响平衡移动,由图象可知催化剂性能,1>2,故正确;
c.升高温度平衡逆向移动,氨气的含量减小,故c错误;
故答案为:b.
点评 本题考查考查化学平衡状态的判断、化学平衡移动的问题等,侧重于化学平衡移动的综合考查,题目难度中等,注意把握平衡常数的意义.

| A. | 干冰能用作冷冻剂 | |
| B. | 明矾可用作净水剂 | |
| C. | 味精可用作食品调味剂 | |
| D. | 苏打是一种膨松剂,可用于制作馒头和面包 |
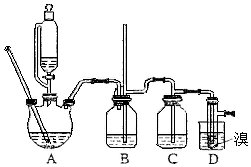 实验室制备1,2-二溴乙烷,用16.0g的溴和足量的乙醇制备1,2-二溴乙烷,实验结束后得到9.4g产品.实验装置如图所示:
实验室制备1,2-二溴乙烷,用16.0g的溴和足量的乙醇制备1,2-二溴乙烷,实验结束后得到9.4g产品.实验装置如图所示:有关数据列表:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/0C | 78.5 | 132 | 34.6 |
| 熔点/0C | -130 | 9 | -116 |
| 溶解性 | 易溶水 | 难溶水 | 微溶于水 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其主要目的是d(填正确选项前的字母;
a、引发反应 b、加快反应速度 c、防止乙醇挥发 d、减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收乙烯中的酸性杂质气体;(填正确选项前的字母)
a、水 b、浓硫酸 c、氢氧化钠溶液 d、酸性KMnO4溶液
(3)判断该制备反应已经结束的最简单的方法是溴的颜色完全褪去.
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”或“下”);
(5)在装置B中较长玻璃导管的作用是防止倒吸、判断装置是否堵塞;
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发,但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞;
(7)本实验中,1,2-二溴乙烷的产率为50%.
| A. | HClO是弱酸,但NaClO强电解质 | |
| B. | HC1、SO2、HBr三种气体都可用浓硫酸干燥 | |
| C. | 向浓氨水中滴加FeCl3饱和溶液,可制得Fe(OH)3胶体 | |
| D. | SO2和SO3都是酸性氧化物,两者的水溶液都是二元强酸 |
| A. | 影响化学反应速率的主要因素是内因,即反应物本身的性质 | |
| B. | 增大反应物浓度,活化分子百分数不变,单位体积内活化分子数增多 | |
| C. | 升高温度,活化分子百分数增大,分子有效碰撞的频率增大,化学反应速率加快 | |
| D. | 使用正催化剂,活化分子百分数不变,但是反应速率加快 |
| A. | 0.1L物质的量浓度为2mol/L的(NH4)2S溶液中含有的S2-数目为0.2×6.02×1023 | |
| B. | 对NaCl溶液和金属钠加热,都会使导电能力增强 | |
| C. | 25℃时,向0.1mol/LCH3COOH溶液中加入少量CH3COONa固体,该溶液中水的电离程度将增大,且Kw不变 | |
| D. | 用惰性电极电解1L 1mol/L的CuSO4溶液,当阴极析出3.2g铜时,加入0.05mol Cu(OH)2固体可将溶液浓度恢复至元浓度 |
| A. | Na→NaOH | B. | FeCl3→FeCl2 | C. | H2→H2O | D. | Cu→CuO |
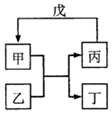 甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各物质中,不满足如图转化关系的是( )
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各物质中,不满足如图转化关系的是( ) | 甲 | 乙 | 丙 | 戊 | |
| ① | SiO2 | NaOH | Na2SiO3 | CO2 |
| ② | Fe | H2O | Fe2O3 | H2 |
| ③ | Al(OH)3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
| ④ | Na2O2 | CO2 | O2 | Na |
| A. | ①③ | B. | ①② | C. | ②④ | D. | ①④ |
