题目内容
在Cu(NO3)2和Al(NO2)3的混合溶液中,硝酸根的物质的量为0.7mol.向该溶液中加入8mol/L的KOH溶液100mL,使之充分反应,反应前,若铝离子的物质的量与混合溶液中的离子总物质的量比值为x,求
(1)x的取值范围 .
(2)若铝离子的物质的量为amol,则a= (用含x的式子表示)
(3)当KOH刚完全消耗且Al3+全部转换成[Al(OH)4]-时,x的取值
(4)设反应中沉淀物总物质的量为ymol,求y与x的关系式.(第4问写出计算过程)
(1)x的取值范围
(2)若铝离子的物质的量为amol,则a=
(3)当KOH刚完全消耗且Al3+全部转换成[Al(OH)4]-时,x的取值
(4)设反应中沉淀物总物质的量为ymol,求y与x的关系式.(第4问写出计算过程)
考点:有关混合物反应的计算
专题:
分析:(1)设溶液中Al3+的物质的量为a mol,利用电荷守恒用a表示出Cu2+的物质的量,溶液中离子总的物质的量为三种离子之和,也等于
mol,据此列等式计算a的值(用x表示),利用极限法可知0<a<
,据此计算x的取值范围;
(2)根据(1)可知a与x的关系;
(3)当KOH刚完全消耗且Al3+全部转换成[Al(OH)4]-时,此时溶液中溶质为KNO3、KAlO2,根据守恒可知n(K+)=n(KNO3-)+n([Al(OH)4]-),n([Al(OH)4]-)=n(Al3+),利用电荷守恒计算n(Cu2+),据此计算x的值;
(4)先确定生成的沉淀①只有氢氧化铜、②氢氧化铜和氢氧化铝的混合物时x的范围,然后分别计算出生成沉淀的物质的量.
| a |
| x |
| 0.7 |
| 3 |
(2)根据(1)可知a与x的关系;
(3)当KOH刚完全消耗且Al3+全部转换成[Al(OH)4]-时,此时溶液中溶质为KNO3、KAlO2,根据守恒可知n(K+)=n(KNO3-)+n([Al(OH)4]-),n([Al(OH)4]-)=n(Al3+),利用电荷守恒计算n(Cu2+),据此计算x的值;
(4)先确定生成的沉淀①只有氢氧化铜、②氢氧化铜和氢氧化铝的混合物时x的范围,然后分别计算出生成沉淀的物质的量.
解答:
解:(1)设溶液中Al3+的物质的量为a mol,由电荷守恒可知Cu2+的物质的量为:
,溶液中离子总的物质的量为三种离子之和,也等于
mol,故
+amol+0.7mol=
mol,解得:a=
,
由极限法可知:0<a<
,故0<=
<
,
解得:0<x<0.25,
故答案为:0<x<0.25;
(2)根据(1)的计算可知,a=
,
故答案为:
;
(3)当KOH刚完全消耗且Al3+全部转换成[Al(OH)4]-时,此时溶液中溶质为KNO3、K[Al(OH)4],根据守恒可知n(K+)=n(NO3-)+n([Al(OH)4]-),故n([Al(OH)4]-)=0.1L×8mol/L-0.7mol=0.1mol,故n(Al3+)=0.1mol,根据电荷守恒可知,n(Cu2+)=
=
=0.2mol,
则:x=
=0.1,
故答案为:0.1;
(4)当x≤0.1时,铝离子完全转化成[Al(OH)4]-,生成的沉淀只有氢氧化铜,根据电荷守恒,生成氢氧化铜的物质的量为:y=
=
;
当0.1<x<0.25时,生成的沉淀为氢氧化铝和氢氧化镁的混合物,
根据电荷守恒,混合液中含有铜离子的物质的量为:n(Cu2+)=
mol=
mol,
与铝离子反应消耗的氢氧根离子的物质的量为:8mol/L×0.1L-
×2mol=
mol,
设生成氢氧化铝的物质的量为m,则溶解的铝离子的物质的量为:
-m,
则铝离子消耗的氢氧根离子的物质的量为:3m+(
-m)×4=
,
解得:m=
,
所以生成氢氧化铝、氢氧化铜沉淀的物质的量y为:y=
+
=
,
答:当x≤0.1时,y=
;当0.1<x<0.25时,y=
.
| 0.7mol-3amol |
| 2 |
| a |
| x |
| 0.7mol-3amol |
| 2 |
| a |
| x |
| 2.1x |
| x+2 |
由极限法可知:0<a<
| 0.7 |
| 3 |
| 2.1x |
| x+2 |
| 0.7 |
| 3 |
解得:0<x<0.25,
故答案为:0<x<0.25;
(2)根据(1)的计算可知,a=
| 2.1x |
| x+2 |
故答案为:
| 2.1x |
| x+2 |
(3)当KOH刚完全消耗且Al3+全部转换成[Al(OH)4]-时,此时溶液中溶质为KNO3、K[Al(OH)4],根据守恒可知n(K+)=n(NO3-)+n([Al(OH)4]-),故n([Al(OH)4]-)=0.1L×8mol/L-0.7mol=0.1mol,故n(Al3+)=0.1mol,根据电荷守恒可知,n(Cu2+)=
| 0.7mol-3n(Al3+) |
| 2 |
| 0.7mol-3×0.1mol |
| 2 |
则:x=
| 0.1mol |
| 0.1mol+0.2mol+0.7mol |
故答案为:0.1;
(4)当x≤0.1时,铝离子完全转化成[Al(OH)4]-,生成的沉淀只有氢氧化铜,根据电荷守恒,生成氢氧化铜的物质的量为:y=
0.7mol-
| ||
| 2 |
| 0.7-2.8x |
| 2+x |
当0.1<x<0.25时,生成的沉淀为氢氧化铝和氢氧化镁的混合物,
根据电荷守恒,混合液中含有铜离子的物质的量为:n(Cu2+)=
0.7mol-
| ||
| 2 |
| 0.7-2.8x |
| 2+x |
与铝离子反应消耗的氢氧根离子的物质的量为:8mol/L×0.1L-
| 0.7-2.8x |
| 2+x |
| 6.4x+0.2 |
| 2+x |
设生成氢氧化铝的物质的量为m,则溶解的铝离子的物质的量为:
| 2.1x |
| x+2 |
则铝离子消耗的氢氧根离子的物质的量为:3m+(
| 2.1x |
| x+2 |
| 6.4x+0.2 |
| 2+x |
解得:m=
| 2x-0.2 |
| 2+x |
所以生成氢氧化铝、氢氧化铜沉淀的物质的量y为:y=
| 2x-0.2 |
| 2+x |
| 0.7-2.8x |
| 2+x |
| 0.5-0.8x |
| 2+x |
答:当x≤0.1时,y=
| 0.7-2.8x |
| 2+x |
| 0.5-0.8x |
| 2+x |
点评:本题考查混合物的有关计算,题目难度中等,注意利用守恒进行的计算,(3)为难点、易错点,需要根据(1)(2)(3)的计算结果及铝离子的物质的量范围讨论生成沉淀的物质的量,计算过程较复杂,需要耐心解答.

练习册系列答案
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
固体X只可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3、AgNO3中的一种或几种组成,某同学对该固体进行了如图实验:
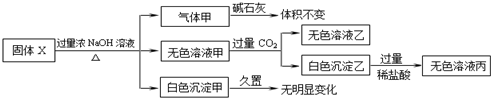
下列判断正确的是( )

下列判断正确的是( )
| A、气体甲一定是纯净物 |
| B、白色沉淀甲可能是混合物 |
| C、固体X中一定存在AlCl3、(NH4)2SO4、MgCl2 |
| D、固体X中一定不存在FeCl2、AgNO3 |
下列根据实验现象所得出的结论中,一定正确的是( )
| A、无色试液加入氯化钡溶液有白色沉淀,结论:试液中含有SO42- |
| B、无色溶液加入硝酸银溶液有白色沉淀,结论:试液中含有Cl- |
| C、无色试液加入Na2CO3溶液产生白色沉淀,结论:试液中含Ca2+ |
| D、某气体能使湿润的红色石蕊试纸变蓝,结论:该气体为NH3 |
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中正确的是( )

| A、常温下,醋酸和ROH溶液的pH之和为14时,等体积混合,所得溶液呈碱性 |
| B、在x点时,ROH完全电离 |
| C、在x点,c(M+)>c(R+) |
| D、稀释前,c(ROH)=10c(MOH) |
下列关于油脂的说法正确的是( )
| A、植物油兼有酯类和烯烃的性质 |
| B、油的熔点高,脂肪的熔点低 |
| C、天然油脂都是单甘油酯 |
| D、羧酸与醇生成的酯就是油脂,沾有油脂的试管可使用纯碱溶液洗涤 |
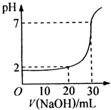 如图为用一定物质的量浓度的NaOH溶液滴定10mL一定物质的量浓度的盐酸的图示.依据图示,推出盐酸和NaOH的物质的量浓度是( )
如图为用一定物质的量浓度的NaOH溶液滴定10mL一定物质的量浓度的盐酸的图示.依据图示,推出盐酸和NaOH的物质的量浓度是( )