题目内容
下列根据实验现象所得出的结论中,一定正确的是( )
| A、无色试液加入氯化钡溶液有白色沉淀,结论:试液中含有SO42- |
| B、无色溶液加入硝酸银溶液有白色沉淀,结论:试液中含有Cl- |
| C、无色试液加入Na2CO3溶液产生白色沉淀,结论:试液中含Ca2+ |
| D、某气体能使湿润的红色石蕊试纸变蓝,结论:该气体为NH3 |
考点:常见阳离子的检验,常见阴离子的检验
专题:
分析:A.根据氯化银为不溶于水的白色沉淀来分析;
B.白色沉淀可能为氯化银、硫酸银、碳酸银等;
C.白色沉淀可能为碳酸钡不一定为碳酸钙;
D.氨气可以是使湿润的红色石蕊试纸变蓝;
B.白色沉淀可能为氯化银、硫酸银、碳酸银等;
C.白色沉淀可能为碳酸钡不一定为碳酸钙;
D.氨气可以是使湿润的红色石蕊试纸变蓝;
解答:
解:A.当溶液中存在大量Ag+时,加入氯化钡溶液时Ag+能与Cl-反应生成白色氯化银沉淀,所以不能肯定溶液中大量存在SO42-,故A错误;
B.当溶液中存在大量Cl-、SO42-、CO32-时,能与Ag+反应分别生成白色氯化银、硫酸银、碳酸银沉淀,所以不能肯定溶液中大量存在Cl-,故B错误;
C.当溶液中只存在钡离子时,加入Na2CO3溶液产生白色沉淀碳酸钡,所以不能肯定溶液中大量存在Ca2+,故C错误;
D.因氨气可以是使湿润的红色石蕊试纸变蓝,则某气体能使湿润的红色石蕊试纸变蓝,结论为该气体为NH3,故D正确;
故选D.
B.当溶液中存在大量Cl-、SO42-、CO32-时,能与Ag+反应分别生成白色氯化银、硫酸银、碳酸银沉淀,所以不能肯定溶液中大量存在Cl-,故B错误;
C.当溶液中只存在钡离子时,加入Na2CO3溶液产生白色沉淀碳酸钡,所以不能肯定溶液中大量存在Ca2+,故C错误;
D.因氨气可以是使湿润的红色石蕊试纸变蓝,则某气体能使湿润的红色石蕊试纸变蓝,结论为该气体为NH3,故D正确;
故选D.
点评:本题考查离子的检验,明确复分解反应发生的条件及离子之间的反应,注意排除某些离子的干扰以及应该加入什么试剂才能排除这些离子的干扰是解答的关键,题目难度不大.

练习册系列答案
相关题目
实验室里需用480mL 0.1mol?L-1的硫酸铜溶液,现用容量瓶进行配制,以下操作确的( )
| A、称取7.68g硫酸铜,加入500mL水 |
| B、称取12.0g胆矾配成500mL溶液 |
| C、称取8.0g硫酸铜配成500mL溶液 |
| D、称取12.5g胆矾配成480mL溶液 |
下列叙述中正确的是( )
| A、两种微粒,若核外电子排布完全相同,其化学性质也一定相同 |
| B、凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 |
| C、两种原子若核外电子排布相同,则一定属于同种元素 |
| D、存在两种质子数和电子数均相同的阳离子和阴离子 |
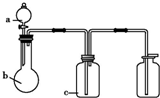 图中a、b、c表示相应仪器中加入的试剂,可用下图装置制取、净化、收集的
图中a、b、c表示相应仪器中加入的试剂,可用下图装置制取、净化、收集的气体是( )
| 编号 | 气体 | a | b | c |
| A | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| B | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3溶液 |
| C | NO | 稀HNO3 | 铜屑 | H2O |
| D | Cl2 | 浓盐酸 | 高锰酸钾 | NaOH溶液 |
| A、A | B、B | C、C | D、D |
 某有机物结构简式如图所示,该有机物不可能发生的化学反应是( )
某有机物结构简式如图所示,该有机物不可能发生的化学反应是( )①氧化 ②取代 ③加成 ④消去 ⑤还原 ⑥酯化 ⑦水解 ⑧加聚.
| A、①④ | B、④⑦ | C、②⑤ | D、⑦⑧ |
