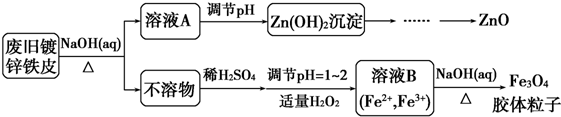
题目内容
14.室温下,在0.1mol/L Na2S溶液中,粒子浓度关系正确的是( )| A. | c(Na+)>c(HS-)>c(OH-)>c (H2S) | B. | c (Na+)+c (H+)=c (S2-)+c (OH-)+c (HS-) | ||
| C. | 2c (Na+)=c (S2-)+c (H2S)+c (HS-) | D. | c(Na+)>c(S2-)>c(OH-)>c (H+) |
分析 在0.1mol/L Na2S溶液中,硫离子部分水解,溶液呈碱性,则c(OH-)>c(H+)、c(Na+)>c(S2-),溶液中离子浓度大小为:c(Na+)>c(S2-)>c(OH-)>c (H+);溶液中还存在电荷守恒:c(Na+)+c(H+)=2c(S2-)+c(OH-)+c(HS-),还存在物料守恒:c(Na+)=2c(S2-)+2c(H2S)+2c(HS-),据此对各选项进行判断.
解答 解:A.Na2S溶液中,硫离子部分水解,溶液呈碱性,则c(OH-)>c(H+)、氢氧根离子还来自水的电离,则c(OH-)>c(HS-),溶液中正确的离子浓度大小为:c(Na+)>c(OH-)>c(HS-)>c (H+),故A错误;
B.根据硫化钠溶液中的电荷守恒可得:c(Na+)+c(H+)=2c(S2-)+c(OH-)+c(HS-),故B错误;
C.根据硫化钠溶液中的物料守恒可得:c(Na+)=2c(S2-)+2c(H2S)+2c(HS-),故C错误;
D.Na2S溶液中硫离子部分水解,溶液呈碱性,则c(OH-)>c(H+)、c(Na+)>c(S2-),溶液中离子浓度大小为:c(Na+)>c(S2-)>c(OH-)>c (H+),故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
4.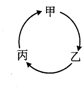 下表所列各组物质中,物质之间不能通过一步反应实现如图所示转化的是
下表所列各组物质中,物质之间不能通过一步反应实现如图所示转化的是
( )
 下表所列各组物质中,物质之间不能通过一步反应实现如图所示转化的是
下表所列各组物质中,物质之间不能通过一步反应实现如图所示转化的是| 选项、物质 | 甲 | 乙 | 丙 |
| A | SO2 | SO3 | H2SO4 |
| B | NH4Cl | NH3 | NO |
| C | Na | NaOH | NaCl |
| D | Al2O3 | AlCl3 | Al(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
2. 保持营养平衡,合理使用药物是保证身心健康、提高生活质量的有效手段.
保持营养平衡,合理使用药物是保证身心健康、提高生活质量的有效手段.
①氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(-NH2)和-COOH(写结构简式).
②发育出现障碍,患营养缺乏症,这主要是由于摄取蛋白质(填“蛋白质”“脂肪”或“糖类”)不足引起的.下列食物中富含该物质的是C(填字母).
A.菠菜B.花生油 C.瘦肉D.西瓜
③如图所示4支试管同时水浴加热4min,为检验其中淀粉的水解程度,某同学的实验操作与现象记录如下:
结合试管1、2中的现象,得出的结论是这两支试管中淀粉没有水解(填“没有”“部分”或“全部”).结合试管3、4中的现象,不能得出“这两支试管中淀粉没有水解”的结论,理由是银镜反应须在碱性环境中进行,未用NaOH溶液中和硫酸.
 保持营养平衡,合理使用药物是保证身心健康、提高生活质量的有效手段.
保持营养平衡,合理使用药物是保证身心健康、提高生活质量的有效手段.①氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(-NH2)和-COOH(写结构简式).
②发育出现障碍,患营养缺乏症,这主要是由于摄取蛋白质(填“蛋白质”“脂肪”或“糖类”)不足引起的.下列食物中富含该物质的是C(填字母).
A.菠菜B.花生油 C.瘦肉D.西瓜
③如图所示4支试管同时水浴加热4min,为检验其中淀粉的水解程度,某同学的实验操作与现象记录如下:
| 编号 | 操作 | 现象 |
| 1 | 加入碘水 | 溶液变成蓝色 |
| 2 | 加入银氨溶液,水浴加热 | 未出现银镜 |
| 3 | 加入碘水 | 溶液变成蓝色 |
| 4 | 加入银氨溶液,水浴加热 | 未出现银镜 |
9.下列反应属于吸热反应的是( )
| A. | 锌粒与稀H2SO4反应制取H2 | |
| B. | 氢气在氧气中燃烧 | |
| C. | 氢氧化钾和硫酸中和 | |
| D. | 碳酸钙高温分解成氧化钙和二氧化碳 |
19.下列涉及有机物性质的说法不正确的是( )
| A. | ①戊烷②丙烷③丁烷沸点高低顺序为①>③>② | |
| B. | CH4与Cl2以体积比1:4混合,光照时可制得纯净的CCl4 | |
| C. | 苯能在一定条件下跟H2加成生成环己烷 | |
| D. | CH2=CH2+H2O→CH3-CH2OH 是加成反应 |
6.在NH4Cl溶液中,下列关系式正确的是( )
| A. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | B. | c(NH4+)>c(Cl-)>c(H+)>c(OH-) | ||
| C. | c(Cl-)=c(NH4+)>c(H+)=c(OH-) | D. | c(NH4+)=c(Cl-)>c (H+)>c(OH-) |
4.在无色、酸性溶液中,能大量共存的是( )
| A. | Ba2+、OH-、NO${\;}_{3}^{-}$、Na+ | B. | K+、Cu2+、SO42-、Cl- | ||
| C. | Na+、K+、HCO3-、SO42- | D. | Mg2+、SO42-、Na+、NO3- |