题目内容
科学家利用太阳能分解水生成的氢气在催化剂作用下与CO2反应生成甲醇(CH3OH),并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol,请回答下列问题:
(1)用太阳能分解5mol水消耗的能量是 kJ.
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 .
(3)已知25℃、101kPa下,H2O(l)═H2O(g)△H=+44kJ?mol-1.则1g甲醇(CH3OH)燃烧生成CO2和气态水时放出的热量为 .
(1)用太阳能分解5mol水消耗的能量是
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为
(3)已知25℃、101kPa下,H2O(l)═H2O(g)△H=+44kJ?mol-1.则1g甲醇(CH3OH)燃烧生成CO2和气态水时放出的热量为
考点:有关反应热的计算,热化学方程式
专题:化学反应中的能量变化
分析:(1)根据氢气的燃烧热可知水分解吸收的能量,然后利用化学计量数与反应热的关系来计算;
(2)根据CO和CH3OH的燃烧热先书写热方程式,再利用盖斯定律来分析甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式;
(3)1mol液态水变成气态水需吸热44KJ,结合CH3OH(l)的燃烧热△H为-726.5kJ/mol求解,气态水时放出的热量少;
(2)根据CO和CH3OH的燃烧热先书写热方程式,再利用盖斯定律来分析甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式;
(3)1mol液态水变成气态水需吸热44KJ,结合CH3OH(l)的燃烧热△H为-726.5kJ/mol求解,气态水时放出的热量少;
解答:
解:(1)由H2(g)的燃烧热△H为-285.8kJ?mol-1知,1molH2(g)完全燃烧生成1molH2O(l)放出热量285.8kJ,
即分解1mol H2O(l)为1mol H2(g)消耗的能量为285.8kJ,则分解5mol H2O(l)消耗的能量为285.8kJ×5=1429kJ,
故答案为:1429;
(2)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ?mol-1和-726.5kJ?mol-1,则
①CO(g)+
O2(g)=CO2(g)△H=-283.0kJ?mol-1
②CH3OH(l)+
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ?mol-1
由盖斯定律可知,②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l),则△H=-726.5kJ?mol-1-(-283.0kJ?mol-1)=-443.5kJ?mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ?mol-1;
(3)CH3OH(l)的燃烧热△H为-726.5kJ/mol,热化学方程式为CH3OH(g)+
O2(g)=CO2(g)+2H2O(l);△H=-726.5kJ/mol,1mol液态水变成气态水需吸热44KJ,若2mol液态水变成水蒸气时则吸热88KJ,热化学方程式为CH3OH(g)+
O2(g)=CO2(g)+2H2O(g);△H=-(726.5-88)kJ/mol=-638.5kJ/mol,则1g甲醇(CH3OH)燃烧生成CO2和气态水时放出的热量为
×638.5kJ≈19.95KJ,
故答案为:19.95KJ;
即分解1mol H2O(l)为1mol H2(g)消耗的能量为285.8kJ,则分解5mol H2O(l)消耗的能量为285.8kJ×5=1429kJ,
故答案为:1429;
(2)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ?mol-1和-726.5kJ?mol-1,则
①CO(g)+
| 1 |
| 2 |
②CH3OH(l)+
| 1 |
| 2 |
由盖斯定律可知,②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l),则△H=-726.5kJ?mol-1-(-283.0kJ?mol-1)=-443.5kJ?mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ?mol-1;
(3)CH3OH(l)的燃烧热△H为-726.5kJ/mol,热化学方程式为CH3OH(g)+
| 3 |
| 2 |
| 3 |
| 2 |
| 1 |
| 32 |
故答案为:19.95KJ;
点评:本题考查反应热的有关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意若为放热反应,则△H为“-”;若为吸热反应,则△H为“+”.对于同一反应来说,计量系数不同,△H不同,题目难度中等.

练习册系列答案
相关题目
两瓶体积相等的气体,一瓶是NO,另一瓶是N2和O2,同温同压时瓶内气体的关系一定正确的是( )
| A、所含原子数相等 |
| B、气体密度相等 |
| C、气体质量相等 |
| D、摩尔质量相等 |
下列化学用语错误的是( )
A、氟离子的结构示意图: |
B、-CH3的电子式: |
C、Na+的电子排布图: |
| D、Na的简化电子排布式:[Ne]3s1 |
不能说明醋酸是弱电解质的事实是( )
| A、醋酸溶液的导电性比盐酸弱 |
| B、向醋酸钠溶液中通入少量氯化氢,c(CH3COO-)减小 |
| C、0.1 mol/L的醋酸溶液的pH约为3 |
| D、pH=1的醋酸溶液用水稀释1000倍后,pH<4 |
化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A、钢铁的腐蚀过程绝大多数都是电化学腐蚀 |
| B、在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
| C、电解CuCl2饱和溶液,生成金属铜和氯气 |
| D、电解MgCl2饱和溶液,可制得金属镁 |
下列说法不正确的是( )
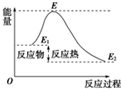

| A、反应物分子(或离子)间的每次碰撞是反应的先决条件 |
| B、反应物的分子的每次碰撞都能发生化学反应 |
| C、活化分子具有比普通分子更高的能量,催化剂能够减低活化能的数值 |
| D、活化能是活化分子的平均能量与所有分子平均能量之差,如图所示正反应的活化能为E-E1 |

 铜和镍是第四周期重要的过渡元素,它们的单质及化合物具有广泛用途,请回答以下问题:
铜和镍是第四周期重要的过渡元素,它们的单质及化合物具有广泛用途,请回答以下问题: ④HCHO,其中碳原子采取sp2杂化的分子有
④HCHO,其中碳原子采取sp2杂化的分子有