题目内容
5.在学习中,我们经常应用类推法.下列表格左边正确,类推法应用于右边也正确的是( )| A | 向FeCl2溶液中滴入氯水2Fe2++Cl2=2Fe3++2C l- | 向FeC l2溶液中滴入碘水2Fe2++I2=2Fe3++2I- |
| B | 向澄清石灰水中通入少量CO2 气体Ca2++2OH-+CO2=CaCO3↓+H2O | 向澄清石灰水中通入少量SO2 气体Ca2++2OH-+SO2=CaSO3↓+H2O |
| C | 向Na2CO3溶液中滴入稀HNO3CO32-+2H+=CO2↑+H2O | 向Na2SO3溶液中滴入稀HNO3SO32-+2H+=SO2↑+H2O |
| D | CO2 通入漂白粉溶液中CO2+Ca2++2ClO-+H2O=CaCO3↓+2HClO | SO2通入漂白粉溶液中SO2+Ca2++2ClO-+H2O=CaSO3↓+2HClO |
| A. | A | B. | B | C. | C | D. | D |
分析 A.FeCl2溶液与碘水不反应;
B.二氧化碳、二氧化硫均为酸性氧化物,与碱反应均生成盐和水;
C.Na2SO3溶液中滴入稀HNO3发生氧化还原反应;
D.SO2通入漂白粉溶液,发生氧化还原反应.
解答 解:A.FeCl2溶液与碘水不反应,则前者发生氧化还原反应,后者不反应,与氧化性强弱有关,故A错误;
B.二氧化碳、二氧化硫均为酸性氧化物,与碱反应均生成盐和水,则类推合理,故B正确;
C.Na2SO3溶液中滴入稀HNO3发生氧化还原反应为:2NO3-+3SO32-+2H+=3SO42-+2NO↑+H2O,故C错误;
D.SO2通入漂白粉溶液,发生氧化还原反应为SO2+Ca2++ClO-+H2O=CaSO4↓+2H++Cl-,故D错误;
故选B.
点评 本题考查离子反应方程式书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,题目难度不大.

练习册系列答案
相关题目
13.实验室用下列装置从NaBr溶液中制备单质溴,其合理的是( )
| A. | 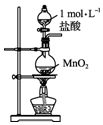 用装置甲制取氯气 | B. | 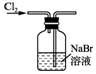 用装置乙氧化溴离子 | ||
| C. | 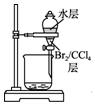 用装置丙分离出溴的CCl4溶液 | D. | 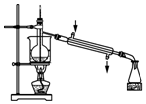 用装置丁获得单质溴 |
14.下列有关物质的俗称,正确的是( )
| A. | Fe2O3--铁红 | B. | SiO2--玛瑙 | C. | Na2SiO3水玻璃 | D. | NaHCO3--苏打 |
11.在实验室和生产生活中,安全是避免伤害和事故的保障.下列处理方法不正确的是( )
| A. | 金属钠着火时立即用沙子盖灭 | |
| B. | 制取有毒气体时需在通风橱中进行 | |
| C. | 将过期的化学药品直接倒入下水道 | |
| D. | 给试管中液体加热时试管口要避开人 |
18.在一定体积的1L密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
下列说法正确的是( )
| t/℃ | 700 | 800 | 830 | 1 000 |
| K | 0.6 | 0.9 | 1.0 | 1.7 |
| A. | 上述生成CO和H2O的反应为放热反应 | |
| B. | 加压、增大H2浓度和加入催化剂都能提高CO2的转化率 | |
| C. | 830℃达平衡后,再充入1.0 mol H2,K值增大,平衡正向移动 | |
| D. | 830℃时反应CO(g)+H2O(g)?CO2(g)+H2(g)的平衡常数为1 |
14.分子式C8H8O2的有机物,其结构中含有苯环且可以与饱和NaHCO3溶液反应放出气体的同分异构体有(不考虑立体异构)( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
15.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A. | 在标准状况下,22.4 L C2H6中含共价键的数目为6 NA | |
| B. | 5 g KHCO3与CaCO3混合固体中阴离子数目为0.05 NA | |
| C. | 常温下,1 L 0.1 mol•L-1CH3COONa溶液中CH3COO-离子数目为0.1 NA | |
| D. | 在Na2O2与H2O的反应中,当转移0.2 NA个电子时生成的O2体积为2.24 L |

 工业上,向500℃左右的铁屑中通入Cl2生产无水氯化铁,其制备过程中均要确保无水.现模拟该过程用图示装置进行实验:
工业上,向500℃左右的铁屑中通入Cl2生产无水氯化铁,其制备过程中均要确保无水.现模拟该过程用图示装置进行实验: