题目内容
11.X、Y、Z、W、G是元素周期表中原子序数依次增大的五种元素.X元素是元素周期表中核电荷数最小的元素.Y的一种核素常用于考古,某一种同素异形体为自然界最硬的物质.ZX3气体溶于水呈碱性.W的外围电子排布是3s1.G2+离子的M层d轨道只有5个电子.请回答下列问题:(1)W在元素周期表中的位置是第三周期第IA族;W和Z形成的化合物水溶液呈碱性,用离子方程式表示其原因N3-+H2O?NH3+OH-.
(2)Z原子的第一电离能比氧原子的大(填“大”或“小”);G的基态原子电子排布式是1s22s22p63s23p63d54s2.
(3)X与Y可形成多种化合物,其中一种化合物的分子式是X6Y6,分子中只有σ键,该分子的结构简式是
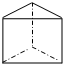 ;该化合物中Y的杂化轨道类型是sp3.
;该化合物中Y的杂化轨道类型是sp3.(4)G的最高价氧化物对应水化物的钾盐,在酸性条件下,常用于测定溶液中Fe2+的含量,该反应的离子方程式是MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O.
(5)可用YX4还原ZOx以消除污染.已知:
YX4(g)+4ZO2(g)═4ZO(g)+YO2(g)+2X2O(g)△H=-574kJ•mol-1
YX4(g)+4ZO(g)═2Z2(g)十YO2(g)+2X2O(g)△H=-1160kJ•mol-1
试写出用YX4还原ZO2至Z2的热化学方程式:CH4 (g)+2NO2 (g)=CO2(g)+N2 (g)+2H2O(g)△H=-867kJ•mol-1.
分析 X、Y、Z、W、G是元素周期表中原子序数依次增大的五种元素,X是元素周期表中核电荷数最小的元素,故X为H元素;Y的一种核素常用于考古,其一种同素异形体为自然界最硬的物质,则Y为C元素;ZX3气体溶于水呈碱性,则Z为N元素;W的外围电子排布是3s1,则W为Na;G2+离子的M层d轨道只有5个电子,原子核外电子排布式为1s22s22p63s23p63d54s2,则G为Mn.
解答 解:X、Y、Z、W、G是元素周期表中原子序数依次增大的五种元素,X是元素周期表中核电荷数最小的元素,故X为H元素;Y的一种核素常用于考古,其一种同素异形体为自然界最硬的物质,则Y为C元素;ZX3气体溶于水呈碱性,则Z为N元素;W的外围电子排布是3s1,则W为Na;G2+离子的M层d轨道只有5个电子,原子核外电子排布式为1s22s22p63s23p63d54s2,则G为Mn.
(1)W是Na元素,位于元素周期表第三周期第IA族;W和Z形成的化合物为Na3N,水溶液呈碱性,用离子方程式表示其原因:N3-+H2O?NH3+OH-;
故答案为:第三周期第IA族;N3-+H2O?NH3+OH-;
(2)N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能大于氧原子;G为Mn元素,基态原子价电子排布式是1s22s22p63s23p63d54s2,
故答案为:大;1s22s22p63s23p63d54s2;
(3)H与C可形成多种化合物,其中一种化合物的分子式是H6C6,分子中只有σ键,该分子的结构简式是 ,碳原子形成4个σ键,没有孤对电子,碳原子杂化方式为sp3杂化,
,碳原子形成4个σ键,没有孤对电子,碳原子杂化方式为sp3杂化,
故答案为: ;sp3;
;sp3;
(4)G的最高价氧化物对应水化物的钾盐为KMnO4,在酸性条件下,常用于测定溶液中Fe2+的含量,该反应的离子方程式是:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,
故答案为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
(5)已知:①CH4 (g)+4NO2 (g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4 (g)+4NO(g)=2N2 (g)+CO2 (g)+2H2O(g)△H=-1160kJ•mol-1
根据盖斯定律①+②得:2CH4 (g)+4NO2 (g)=2CO2(g)+2N2 (g)+4H2O(g)△H=-1734kJ•mol-1,
即热化学方程式为CH4 (g)+2NO2 (g)=CO2(g)+N2 (g)+2H2O(g)△H=-867kJ•mol-1,
故答案为:CH4 (g)+2NO2 (g)=CO2(g)+N2 (g)+2H2O(g)△H=-867kJ•mol-1.
点评 本题是对物质结构的考查,涉及结构性质位置关系、电离能、核外电子排布、分子结构、杂化方式、氧化还原反应、热化学方程式书写等,注意对理解掌握同周期第一电离能异常原因.

①加入AgNO3溶液
②加入NaOH水溶液
③加热
④加蒸馏水
⑤冷却后加入HNO3酸化
⑥加入NaOH的乙醇溶液.
| A. | ④③①⑤ | B. | ②③⑤① | C. | ⑥③④① | D. | ⑥③①⑤ |
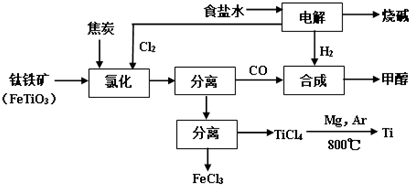
已知:合成甲醇的主反应为:CO+2H2?CH3OH+Q(Q>0,下同);
同时有副反应如:8CO+17H2?C8H18+8H2O+Q
4CO+8H2?C4H9OH+3H2O+Q.
请完成下列填空:
(1)在实验室电解饱和食盐水时,因工业食盐中含有少量氯化钙、硫酸镁等杂质,除杂时先加入沉淀剂,然后过滤,滤渣的成分是BaSO4、CaCO3、BaCO3、Mg(OH)2(填写化学式).
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式2FeTiO3+6C+7Cl2$\frac{\underline{\;通电\;}}{\;}$2TiCl4+2FeCl3+6CO.
(3)诸如上述联合生产,其优点有大大提高资源利用率;降低生产成本;减少环境污染等.生产中除了获得上述目标产品外,还能得到副产品C8H18、C4H9OH、FeCl3、MgCl2(填写化学式).
(4)在上述产业链中,合成192吨甲醇理论上需额外补充H210吨(不考虑生产过程中物质的损失及副反应).
(5)上述产业链中“氯化”在600℃以上的反应器内进行.已知:
| 物质 | 沸点(℃) |
| TiCl4 | 136 |
| FeCl3 | 315 |
| A. | 滴加KI溶液时,KI被氧化,CuI是还原产物 | |
| B. | 通入SO2后,溶液变无色,体现SO2的还原性 | |
| C. | 上述实验条件下,物质的氧化性:Cu2+>I2>SO2 | |
| D. | 整个过程发生了复分解反应和氧化还原反应 |

| A. | 8种 | B. | 5种 | C. | 4种 | D. | 3种 |
| 选项 | 离子组 | 试剂 | 发生反应的离子方程式 |
| A | K+、AlO2-、NO3- | 过量CO2 | CO2+2H2O+AlO2-=Al(OH)3↓+HCO3- |
| B | Fe3+、I-、ClO- | 少量NaOH溶液 | Fe3++3OH-=Fe(OH) 3↓ |
| C | Ca2+、Na+、OH- | 少量NaHCO3溶液 | HCO3-+OH-=CO32-+H2O |
| D | NH4+、HCO3-、Cl- | 少量NaOH溶液 | NH4++OH-=NH3•H2O |
| A. | A | B. | B | C. | C | D. | D |
| A. | O.lmol铁粉与足量水蒸气反应生成的H2分子数目为0.1NA | |
| B. | 分子数目为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数为0.3NA | |
| C. | 电解饱和食盐水时,当阴极产生H2 22.4L时,电路中转移的电子数为2NA | |
| D. | 常温常压下,4.4g乙醛所含σ键数目为0.7NA |
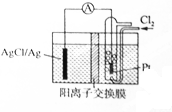 某原电池装置如图所示,电池总反应为2Ag+Cl2═2AgCl,电解液为1mol•L-1的盐酸.下列说法正确的是( )
某原电池装置如图所示,电池总反应为2Ag+Cl2═2AgCl,电解液为1mol•L-1的盐酸.下列说法正确的是( )| A. | 正极反应为AgCl+e-═Ag+Cl- | |
| B. | 放电时交换膜右侧溶液中有大量白色沉淀生成 | |
| C. | 放电后交换膜溶液酸性增强 | |
| D. | 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02mol离子 |