题目内容
1.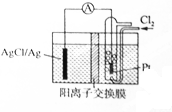 某原电池装置如图所示,电池总反应为2Ag+Cl2═2AgCl,电解液为1mol•L-1的盐酸.下列说法正确的是( )
某原电池装置如图所示,电池总反应为2Ag+Cl2═2AgCl,电解液为1mol•L-1的盐酸.下列说法正确的是( )| A. | 正极反应为AgCl+e-═Ag+Cl- | |
| B. | 放电时交换膜右侧溶液中有大量白色沉淀生成 | |
| C. | 放电后交换膜溶液酸性增强 | |
| D. | 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02mol离子 |
分析 根据电池总反应为2Ag+Cl2═2AgCl可知,Ag失电子作负极失电子,氯气在正极上得电子生成氯离子,负极反应式为Ag-e-+Cl-=AgCl,正极反应式为Cl2+2e-═2Cl-,以此解答该题.
解答 解:A.正极上氯气得电子生成氯离子,其电极反应为:Cl2+2e-═2Cl-,故A错误;
B.放电时,交换膜左侧溶液中生成银离子,银离子与氯离子反应生成氯化银沉淀,所以交换膜左侧溶液中有大量白色沉淀生成,故B错误;
C.负极反应式为Cl-+Ag-e-=AgCl↓,正极反应式为Cl2+2e-═2Cl-,氢离子会通过阳离子交换膜移至右侧,所以放电时左边盐酸浓度降低、右边升高,右侧溶液酸性增强,故C正确;
D.放电时,当电路中转移0.01mol e-时,交换膜左则会有0.01mol氢离子通过阳离子交换膜向正极移动,同时会有0.01molAg失去0.01mol电子生成银离子,银离子会与氯离子反应生成氯化银沉淀,所以氯离子会减少0.01mol,则交换膜左侧溶液中约减少0.02mol离子,故D正确.
故选:CD.
点评 本题考查了原电池原理的应用及沉淀反应,为高频考点,注意把握原电池原理及正负极的判断和电极方程式的书写,利用电子及电荷守恒来解决原电池中有关计算的问题,题目难度中等.

练习册系列答案
相关题目
12.有X、Y、Z、T、U五种短周期元素.X、Y、Z三元素在周期表中的位置如图所示,三元素的原子序数之和是41.X和T的单质在不同条件下反应,可以生成T2X(白色固体)和T2X2(淡黄色固体)两种化合物.U单质在Z单质中燃烧时产生苍白色火焰,生成物的水溶液能使石蕊试液变红.
(1)各元素的符号是:ZCl,TNa
(2)Y原子的结构示意图为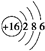 ,U2X的电子式
,U2X的电子式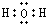
(3)YX2和U2Y反应的化学方程式为2H2S+SO2═3S↓+2H2O,其中氧化剂是SO2,被氧化的元素是S.
| X | |
| Y | Z |
(2)Y原子的结构示意图为
 ,U2X的电子式
,U2X的电子式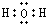
(3)YX2和U2Y反应的化学方程式为2H2S+SO2═3S↓+2H2O,其中氧化剂是SO2,被氧化的元素是S.
9.CH3-CH2-OH和CH3-O-CH3互为( )
| A. | 同分异构体 | B. | 同素异形体 | C. | 同位素 | D. | 同系物 |
16.下列各组有机物只用一种试剂无法鉴别的是( )
| A. | 乙醇、戊烷、硝基苯 | B. | 苯、四氯化碳、己烯 | ||
| C. | 苯、甲苯、环己烷 | D. | 甲醇、乙酸乙酯、乙酸 |
13.复盐M【K3Fe(A2B4)3•3H2O】可用于蓝色印刷和摄影,某小组同学将纯净的化合物M在一定条件下加热分解,对所得其他产物和固体产物进行实验和探究.
(1)Fe元素在周期表中的位置是第四周期第ⅤⅢ族,验证固体产物中存在钾元素的方法是做焰色反应实验,透过蓝色钴玻璃观察火焰的颜色呈紫色.
(2)经分析,所得其他产物由甲、乙和水蒸气组成,甲、乙转化关系如图(Ⅰ),转化时的能力变化如图(Ⅱ),已知A是形成化合物种类最多的元素,B是地壳中含量最多的元素,X、Y、甲、乙是含A、B两元素的单质或化合物,则化合物乙的电子式为 ,写出反应X+Y→甲的热化学方程式:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.6KJ/mol.
,写出反应X+Y→甲的热化学方程式:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.6KJ/mol.

(3)该小组同学已知固体产物中,铁元素不以三价形式存在,而盐也只有K2AB3,为了进一步确定复盐M的分解反应方程式,小组同学对固体产物进行定量测量.
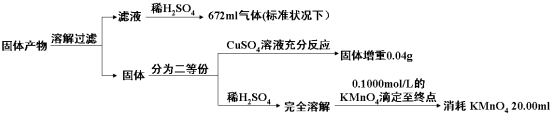
判断KMnO4(其还原产物为无色Mn2+溶液)溶液与试样反应到达滴定终点的现象为当加入最后一滴酸性高锰酸钾溶液时试样由无色变化为紫红色且振荡半分钟内部变化.由以上实验数据的分析可知,加热后所得固体产物中除K2AB3外还含有什么物质?它们之间的物质的量之比为多少?请把你的结论填入表中(可以不填满或补充空格).
(4)通过以上结论,复盐M加热分解的反应方程式为2K3Fe(C2O4)3•3H2O$\frac{\underline{\;\;△\;\;}}{\;}$3K2CO3+Fe+FeO+5CO2↑+4CO↑+6H2O.
(5)已知KHA2B4溶液呈酸性,向10mL0.01mol•L-1的H2A2O4溶液滴加0.01mol•L-1KOH溶液V(mL),下列叙述正确的是①②③.
①当V<10mL时,反应的离子方程式为H2A2B4+OH-=HA2B4++H2O
②当V=10mL时,溶液中C(HA2B4+)>C(H+)>C(A2B42-)>C(H2A2B4)
③当V=amL时,溶液中离子浓度的关系为c(K+)=2c(A2B42-)+c(HA2B4-)
若V=bmL时,溶液中离子浓度的关系为:c(K+)=c(A2B42-)+c(HA2B4-)+c(H2A2B4),则a>b.
(1)Fe元素在周期表中的位置是第四周期第ⅤⅢ族,验证固体产物中存在钾元素的方法是做焰色反应实验,透过蓝色钴玻璃观察火焰的颜色呈紫色.
(2)经分析,所得其他产物由甲、乙和水蒸气组成,甲、乙转化关系如图(Ⅰ),转化时的能力变化如图(Ⅱ),已知A是形成化合物种类最多的元素,B是地壳中含量最多的元素,X、Y、甲、乙是含A、B两元素的单质或化合物,则化合物乙的电子式为
 ,写出反应X+Y→甲的热化学方程式:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.6KJ/mol.
,写出反应X+Y→甲的热化学方程式:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.6KJ/mol.
(3)该小组同学已知固体产物中,铁元素不以三价形式存在,而盐也只有K2AB3,为了进一步确定复盐M的分解反应方程式,小组同学对固体产物进行定量测量.

判断KMnO4(其还原产物为无色Mn2+溶液)溶液与试样反应到达滴定终点的现象为当加入最后一滴酸性高锰酸钾溶液时试样由无色变化为紫红色且振荡半分钟内部变化.由以上实验数据的分析可知,加热后所得固体产物中除K2AB3外还含有什么物质?它们之间的物质的量之比为多少?请把你的结论填入表中(可以不填满或补充空格).
| 固体产物中的成分 | K2AB3 | … | ||
| 物质的量之比 | ||||
(5)已知KHA2B4溶液呈酸性,向10mL0.01mol•L-1的H2A2O4溶液滴加0.01mol•L-1KOH溶液V(mL),下列叙述正确的是①②③.
①当V<10mL时,反应的离子方程式为H2A2B4+OH-=HA2B4++H2O
②当V=10mL时,溶液中C(HA2B4+)>C(H+)>C(A2B42-)>C(H2A2B4)
③当V=amL时,溶液中离子浓度的关系为c(K+)=2c(A2B42-)+c(HA2B4-)
若V=bmL时,溶液中离子浓度的关系为:c(K+)=c(A2B42-)+c(HA2B4-)+c(H2A2B4),则a>b.
11.下列化学实验事实及解释或者结论都正确的是( )
| A. | 将某气体燃烧,在火焰的上方罩一个冷而干燥的烧杯,烧杯内壁有水珠生成,再将烧杯立即倒转并加入澄清石灰水溶液震荡,石灰水变浑浊,则该气体一定是烃 | |
| B. | 除去乙酸乙酯中少量的乙酸,用饱和的碳酸钠溶液洗涤,然后分液、干燥、蒸馏 | |
| C. | 1ml 1%的NaOH溶液中加入2ml 2%的CuSO4溶液,振荡后再加入0.5ml淀粉的水解液,加热后未出现砖红色沉淀,说明淀粉尚未水解 | |
| D. | 乙酸和乙醇的酯化反应实验中,向试管中加入试剂的顺序是:浓硫酸、乙醇、冰醋酸 |
 ;该化合物中Y的杂化轨道类型是sp3.
;该化合物中Y的杂化轨道类型是sp3.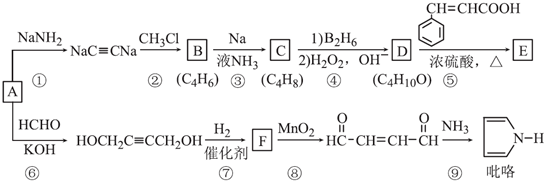
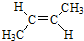 .
.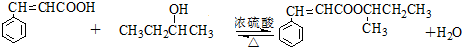 .
.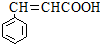 )的同分异构体中,含有苯环和碳碳双键,且能够发生水解反应的共有7种(不考虑顺反异构).与D互为同分异构体,且核磁共振氢谱有面积比为2:3的两组峰的有机物的结构简式是CH3CH2OCH2CH3.
)的同分异构体中,含有苯环和碳碳双键,且能够发生水解反应的共有7种(不考虑顺反异构).与D互为同分异构体,且核磁共振氢谱有面积比为2:3的两组峰的有机物的结构简式是CH3CH2OCH2CH3.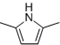 )的合成路线
)的合成路线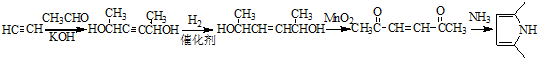 .
.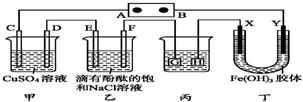 如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.