题目内容
20.设NA表示阿伏加德罗常数,下列叙述正确的是( )| A. | O.lmol铁粉与足量水蒸气反应生成的H2分子数目为0.1NA | |
| B. | 分子数目为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数为0.3NA | |
| C. | 电解饱和食盐水时,当阴极产生H2 22.4L时,电路中转移的电子数为2NA | |
| D. | 常温常压下,4.4g乙醛所含σ键数目为0.7NA |
分析 A、铁和水蒸气反应时,3mol铁生成4mol氢气;
B、N2中含3条共价键,NH3中也含3条共价键;
C、阴极生成的气体所处的状态不明确;
D、求出乙醛的物质的量,然后根据1mol乙醛中含6molσ键来分析.
解答 解:A、铁和水蒸气反应时,3mol铁生成4mol氢气,故0.1mol铁生成$\frac{4}{30}$mol氢气,故A错误;
B、N2中含3条共价键,NH3中也含3条共价键,故0.1molN2和NH3混合气体中含共价键0.3mol,即0.3NA对共用电子对,故B正确;
C、阴极生成的气体所处的状态不明确,故生成的氢气的物质的量无法计算,故C错误;
D、4.4g乙醛的物质的量为0.1mol,而1mol乙醛中含6molσ键,故0.1mol乙醛中含0.6NA条σ键,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
15.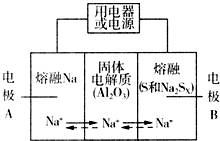 钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
Na2SX$?_{放电}^{充电}$2Na+XS (3<X<5)
(4)根据上表数据,判断该电池工作的适宜温度应为C(填字母序号).
A.100℃以下 B.100℃~300℃
C.300℃~350℃D.350℃~2050℃
(5)关于钠硫电池,下列说法正确的是AD(填字母序号).
A.放电时,电极A为负极
B.放电时,Na+的移动方向为从B到A
C.充电时,电极A应连接电源的正极
D.充电时电极B的电极反应式为SX2--2e-=xS
(6)25℃时,若用钠硫电池作为电源电解500mL 0.2mol•L-1 NaCl溶液,当溶液的pH变为l3时(忽略电解前后溶液的体积变化),电路中通过的电子的物质的量为
0.05mol,钠硫电池两极的反应物的质量差为2.3 g.(假设电解前钠硫电池两极的反应物质量相等)
 钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:Na2SX$?_{放电}^{充电}$2Na+XS (3<X<5)
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
A.100℃以下 B.100℃~300℃
C.300℃~350℃D.350℃~2050℃
(5)关于钠硫电池,下列说法正确的是AD(填字母序号).
A.放电时,电极A为负极
B.放电时,Na+的移动方向为从B到A
C.充电时,电极A应连接电源的正极
D.充电时电极B的电极反应式为SX2--2e-=xS
(6)25℃时,若用钠硫电池作为电源电解500mL 0.2mol•L-1 NaCl溶液,当溶液的pH变为l3时(忽略电解前后溶液的体积变化),电路中通过的电子的物质的量为
0.05mol,钠硫电池两极的反应物的质量差为2.3 g.(假设电解前钠硫电池两极的反应物质量相等)
5.下列表示方法正确的是( )
| A. | HCl的电子式为 | B. | N2的结构式 N≡N | ||
| C. | O原子处于基态的轨道表示式: | D. | 用电子式表示MgCl2的形成: |
12.有X、Y、Z、T、U五种短周期元素.X、Y、Z三元素在周期表中的位置如图所示,三元素的原子序数之和是41.X和T的单质在不同条件下反应,可以生成T2X(白色固体)和T2X2(淡黄色固体)两种化合物.U单质在Z单质中燃烧时产生苍白色火焰,生成物的水溶液能使石蕊试液变红.
(1)各元素的符号是:ZCl,TNa
(2)Y原子的结构示意图为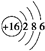 ,U2X的电子式
,U2X的电子式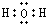
(3)YX2和U2Y反应的化学方程式为2H2S+SO2═3S↓+2H2O,其中氧化剂是SO2,被氧化的元素是S.
| X | |
| Y | Z |
(2)Y原子的结构示意图为
 ,U2X的电子式
,U2X的电子式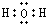
(3)YX2和U2Y反应的化学方程式为2H2S+SO2═3S↓+2H2O,其中氧化剂是SO2,被氧化的元素是S.
9.CH3-CH2-OH和CH3-O-CH3互为( )
| A. | 同分异构体 | B. | 同素异形体 | C. | 同位素 | D. | 同系物 |
 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题: ;该化合物中Y的杂化轨道类型是sp3.
;该化合物中Y的杂化轨道类型是sp3.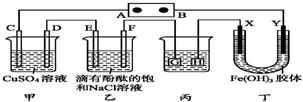 如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.