题目内容
17.在一密闭的2L容器中装有4mol SO2和2mol O2,在一定条件下开始反应2SO2(g)+O2(g)2SO3(g).2min末测得容器中有1.6mol SO2,请计算:(1)2min末SO3的浓度;
(2)2min内SO2的平均反应速率.
(3)2min末SO2的转化率.
(4)反应前后的压强之比.
分析 (1)计算参加反应的二氧化硫的物质的量,根据物质的量之比等于化学计量数之比计算生成的三氧化硫的物质的量,再根据c=$\frac{n}{V}$计算;
(2)根据v=$\frac{△c}{△t}$计算;
(3)二氧化硫的转化率=$\frac{c(S{O}_{2})消耗}{c(S{O}_{2})起始}$计算;
(4)气体压强之比等于气体物质的量之比计算.
解答 解:(1)2min末测得容器中有1.6mol SO2,则参加反应的二氧化硫物质的量为4mol-1.6mol=2.4mol,由方程式可知生成的三氧化硫的物质的量为2.4mol,故三氧化硫的浓度为$\frac{2.4mol}{2L}$1.2mol/l
答:2min末SO3的浓度为1.2mol/L;
(2)v(SO2)=$\frac{1.2mol/L}{2min}$=0.6mol•l-1•min-1
答:2min内SO2的平均反应速率为0.6 mol/(L.min);
(3)二氧化硫的转化率为$\frac{2.4mol}{4mol}$=60%
答:二氧化硫的转化率为60%;
(4)由(1)知参加反应的二氧化硫为2.4mol,根据反应,参与反应的氧气为$\frac{1}{2}$×2.4mol=1.2mol,生成的三氧化硫为2.4mol,气体压强之比等于气体物质的量之比,反应前后的压强之比=反应前后的物质的量之比,则为(4mol+2mol):(1.6mol+0.8mol+2.4mol)=5:4;
答:反应前后的压强之比为5:4.
点评 本题考查化学平衡有关计算、化学反应速率、浓度概念的计算,比较基础,注意气体压强之比等于气体物质的量之比和计算.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.下列溶液中Cl-物质的量浓度与25mL1mol/L AlCl3溶液的Cl-物质的量浓度相等的是( )
| A. | 100mL2.5mol/L NaCl溶液 | B. | 200mL2mol/L MgCl2溶液 | ||
| C. | 300mL3mol/L KCl溶液 | D. | 150mL2mol/L AlCl3溶液 |
8.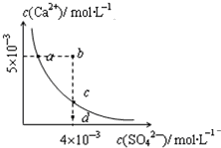 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水溶液中的沉淀溶解平衡曲线见如图.下列说法不正确的是( )
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水溶液中的沉淀溶解平衡曲线见如图.下列说法不正确的是( )
 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水溶液中的沉淀溶解平衡曲线见如图.下列说法不正确的是( )
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水溶液中的沉淀溶解平衡曲线见如图.下列说法不正确的是( )| A. | CaSO4溶解在水中,c(Ca2+)=c(SO42-)=3×10-3mol/L | |
| B. | 在d点溶液中加入一定量的CaCl2可能会有沉淀析出 | |
| C. | a点对应的Ksp等于c点对应的Ksp | |
| D. | b点将有沉淀生成,平衡后溶液中c(SO42-)等于3×10-3mol/L |
12.700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g).反应过程中测定的部分数据见下表(表中t1<t2).下列说法正确的是( )
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1min内的平均速率为v(H2)=$\frac{0.4}{{t}_{1}}$mol.L-1.min-1 | |
| B. | 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 | |
| C. | 保持其他条件不变,若向平衡体系中再通入0.20mol H2O,与原平衡相比,达到新平衡时CO和H2O的转化率均增大 | |
| D. | 保持其他条件不变,若起始时向容器中充入0.60mol CO和1.20 mol H2O,则到达平衡时,n(CO2)=0.40 mol |
9.原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.将等物质的量的X、Y的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下发生可逆反应.下列说法中,正确的是( )
| A. | 达到化学平衡时,正反应速率与逆反应速率不相等 | |
| B. | 反应过程中,Y的单质的体积分数始终为50% | |
| C. | 达到化学平衡时,X、Y的两种单质在混合气体中的物质的量之比为1:1 | |
| D. | 达到化学平衡的过程中,混合气体平均相对分子质量逐渐减小 |
6. 碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.
碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.
(1)已知:①2CH4(g)+3O2(g)?2CO(g)+4H2O(l)△H1=-1214.6kJ/mol
②2CO(g)+O2(g)?2CO2(g)△H2=-566kJ/mol,
则甲烷与氧气反应生成二氧化碳和液态水的热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ/mol.
(2)已知在恒温恒压下密闭容器的可逆反应CH4(g)+H2O(g)?CO(g)+3H2(g)
①该可逆反应一定达到平衡的标志是CD.
A.v(CH4)正=3v(H2)逆
B.水蒸气的浓度与一氧化碳的浓度相等
C.平均相对分子质量不随时间的变化而变化
D.密度不随时间的变化而变化
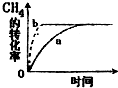
②该可逆反应在不同条件下,测得CH4转化率随时间变化如图所示,与实验a相比,b的实验条件是增加了催化剂.
(3)将不同物质的量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)?CO2(g)+H2(g);△H得到如表三组数据:
①实验1中以v(H2)表示的反应速率为0.16mol•(L•min-1).
②实验2中的平衡常数是0.17(计算结果保留两位小数).
③该反应的△H<0(填“>”或“<”).
④若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),则a、b应满足的关系是b=2a或a:b=1:2(用含a、b的式子表示).
 碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.
碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.(1)已知:①2CH4(g)+3O2(g)?2CO(g)+4H2O(l)△H1=-1214.6kJ/mol
②2CO(g)+O2(g)?2CO2(g)△H2=-566kJ/mol,
则甲烷与氧气反应生成二氧化碳和液态水的热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ/mol.
(2)已知在恒温恒压下密闭容器的可逆反应CH4(g)+H2O(g)?CO(g)+3H2(g)
①该可逆反应一定达到平衡的标志是CD.
A.v(CH4)正=3v(H2)逆
B.水蒸气的浓度与一氧化碳的浓度相等
C.平均相对分子质量不随时间的变化而变化
D.密度不随时间的变化而变化
②该可逆反应在不同条件下,测得CH4转化率随时间变化如图所示,与实验a相比,b的实验条件是增加了催化剂.
(3)将不同物质的量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)?CO2(g)+H2(g);△H得到如表三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | D | t |
②实验2中的平衡常数是0.17(计算结果保留两位小数).
③该反应的△H<0(填“>”或“<”).
④若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),则a、b应满足的关系是b=2a或a:b=1:2(用含a、b的式子表示).
7.将一定量纯净的 X 置于某 10L 容积恒定的真空容器中(假设固体试样体积忽略不计),在恒定温度下使其达到分解平衡:X(s)?2Y(g)+Z(g),实验测得不同温度下的分解平衡常数列于如表,下列说法中不正确的是( )
| 温度( oC) | 15.0 | 25.0 | 30.0 | 35.0 |
| K/(×10-8 mol3•L-3) | 0.205 | 1.64 | 4.68 | 10.8 |
| A. | 若Z的体积分数不再随时间变化时表示反应达平衡状态 | |
| B. | 35 oC时,达平衡时,X分解了 0.03 mol | |
| C. | 该反应在高温下可能自发 | |
| D. | 若在恒温下,压缩容器体积,再次达平衡后,n(X)比原平衡大 |
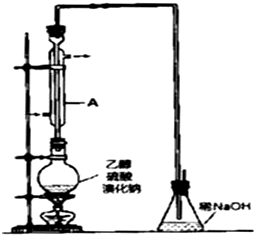 有机化工原料溴乙烷的沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,该反应的化学方程式是CH3CH2OH+HBr→CH3CH2Br+H2O.
有机化工原料溴乙烷的沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,该反应的化学方程式是CH3CH2OH+HBr→CH3CH2Br+H2O. 某温度时,向某V L的密闭容器中充入3molH2(g)和3mol I2(g),发生反应:
某温度时,向某V L的密闭容器中充入3molH2(g)和3mol I2(g),发生反应: