题目内容
10.目前,全世界的镍消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大的潜力.镍化合物中的三氧化二镍是一种重要的电子元件材料和二次电池材料.工业上可利用含镍合金废料(除镍外,还含有Fe、Cu、Ca、Mg、C等杂质)制取草酸镍,然后高温煅烧草酸镍来制取三氧化二镍.已知:①草酸的钙、镁、镍盐均难溶于水,且溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O
②常温下,Ksp[(Fe(OH))3]=4.0×10-38,lg5=0.7
根据下列工艺流程图回答问题:
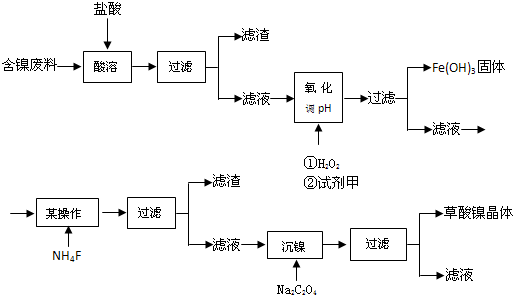
(1)加6%的H2O2时,温度不能太高,其目的是减少过氧化氢的分解.若H2O2在一开始酸溶时便与盐酸一起加入,会造成酸溶过滤后的滤液中增加一种金属离子,用离子方程式表示这一情况Cu+H2O2+2H+=Cu2++2H2O.
(2)流程中有一步是调pH,使Fe3+转化为Fe(OH)3沉淀,常温下当溶液中c(Fe3+)=0.5×10-5mol/L时,溶液的pH=3.3.
(3)流程中加入NH4F的目的是除去Ca2+、Mg2+.
(4)将最后所得的草酸镍晶体在空气中强热到400℃,可生成三氧化二镍和无毒气体,写出该反应的化学方程式4(NiC2O4•2H2O)+3O2 $\frac{\underline{\;△\;}}{\;}$2Ni2O3+8CO2+8H2O.
(5)工业上还可用电解法制取三氧化二镍,用NaOH溶液调节NiCl2溶液的pH至7.5,再加入适量Na2SO4进行电解,电解产生的Cl2其80%的可将二价镍氧化为三价镍.写出Cl2氧化Ni(OH)2生成三氧化二镍的离子方程式Cl2+2Ni(OH)2+2OH-=Ni2O3+2Cl-+3H2O;将a mol二价镍全部转化为三价镍时,外电路中通过电子的物质的量是1.25amol.
(6)近年来镍氢电池发展很快,它可由NiO(OH)跟LaNi5H6(LaNi5H6中各元素化合价均可看作是零)组成:6NiO(OH)+LaNi5H6$?_{充电}^{放电}$LaNi5+6Ni(OH)2.该电池放电时,负极反应是LaNi5H6+6OH--6e-=LaNi5+6 H2O.
分析 含镍废料用盐酸溶解,Cu、C不与盐酸反应,过滤得到滤渣中含有Cu、C,滤液中含有NiCl2、FeCl2、MgCl2、CaCl2及过量的HCl,加入H2O2将Fe2+氧化为Fe3+,加入镍的混合物调节pH使Fe3+转化为Fe(OH)3沉淀,过滤除去,滤液中含有NiCl2、MgCl2、CaCl2,向滤液中加入NH4F,过滤,再向滤液中加入Na2C2O4,过滤得到草酸镍晶体,故加入NH4F应是除去溶液中Ca2+、Mg2+.
(1)过氧化氢受热易分解,所以温度不能过高;Fe、Ca、Mg均与盐酸直接反应,过氧化氢的加入造成酸溶过滤后的滤液中增加一种金属离子,则该金属离子只能是铜离子;
(2)根据Ksp[(Fe(OH))3]计算反应中c(OH-),再根据水的离子积计算c(H+),调节溶液pH=-lgc(H+);
(3)加入NH4F后的操作是过滤,说明该过程有沉淀产生,所以加入NH4F的目的是除去Ca2+、Mg2+;
(4)根据题目可知无毒气体是二氧化碳,同时有水生成,由氧元素守恒可知,应有氧气参加反应,配平书写方程式;
(5)根据氧化还原反应理论,Cl2氧化Ni(OH)2生成三氧化二镍,自身被还原为氯离子,还有水生成,配平书写化学方程式,根据电子转移守恒计算反应中需要氯气物质的量,再根据氯气利用率计算电解生成氯气物质的量,根据电子转移守恒计算电路中通过电子;
(6)NiO(OH)中Ni的化合价是+3价,Ni(OH)2中Ni是+2价,化合价降低,发生还原反应,所以放电时负极应发生氧化反应,LaNi5H6为负极反应物质,LaNi5H6中各元素化合价均可看作是零,所以化合价升高的只能是H元素,碱性条件下得到LaNi5与H2O.
解答 解:含镍废料用盐酸溶解,Cu、C不与盐酸反应,过滤得到滤渣中含有Cu、C,滤液中含有NiCl2、FeCl2、MgCl2、CaCl2及过量的HCl,加入H2O2将Fe2+氧化为Fe3+,加入镍的混合物调节pH使Fe3+转化为Fe(OH)3沉淀,过滤除去,滤液中含有NiCl2、MgCl2、CaCl2,向滤液中加入NH4F,过滤,再向滤液中加入Na2C2O4,过滤得到草酸镍晶体,故加入NH4F应是除去溶液中Ca2+、Mg2+.
(1)过氧化氢受热易分解,所以温度不能过高的目的是减少过氧化氢的分解;Fe、Ca、Mg均与盐酸直接反应,过氧化氢的加入造成酸溶过滤后的滤液中增加一种金属离子,则该金属离子只能是铜离子,所以反应的离子方程式为:Cu+H2O2+2H+=Cu2++2H2O,
反应答案为:减少过氧化氢的分解;Cu+H2O2+2H+=Cu2++2H2O;
(2)Ksp[(Fe(OH))3]=4.0×10-38=c(Fe3+)×[c(OH-)]3,则[c(OH-)]3=8×10-33mol/L,则c(OH-)=2×10-11mol/L,所以c(H+)=5×10-4,故pH=-lg5×10-4=3.3,
故答案为:3.3;
(3)加入NH4F后的操作是过滤,说明该过程有沉淀产生,所以加入NH4F的目的是除去Ca2+、Mg2+,故答案为:除去Ca2+、Mg2+;
(4)根据题目可知无毒气体是二氧化碳,同时有水生成,由氧元素守恒可知,应有氧气参加反应,所以化学方程式为4(NiC2O4•2H2O)+3O2 $\frac{\underline{\;△\;}}{\;}$2Ni2O3+8CO2+8H2O,
故答案为:4(NiC2O4•2H2O)+3O2 $\frac{\underline{\;△\;}}{\;}$2Ni2O3+8CO2+8H2O;
(5)根据氧化还原反应理论,Cl2氧化Ni(OH)2生成三氧化二镍,自身被还原为氯离子,还有水生成,化学方程式为:Cl2+2Ni(OH)2+2OH-=Ni2O3+2Cl-+3H2O;amol二价镍全部转化为三价镍时,根据电子转移守恒需要氯气$\frac{amol×1}{2}$=0.5amol,氯气的利用率是80%,则电解过程中的氯气是$\frac{0.5amol}{80%}$=0.625a mol,每生成1mol氯气转移2mol电子,所以外电路中通过电子的物质的量是0.625a mol×2=1.25amol,
故答案为:Cl2+2Ni(OH)2+2OH-=Ni2O3+2Cl-+3H2O;1.25amol;
(6)NiO(OH)中Ni的化合价是+3价,Ni(OH)2中Ni是+2价,化合价降低,发生还原反应,所以放电时负极应发生氧化反应,LaNi5H6为负极反应物质,LaNi5H6中各元素化合价均可看作是零,所以化合价升高的只能是H元素,碱性条件下得到LaNi5与H2O,电极反应式为:LaNi5H6+6OH--6e-=LaNi5+6 H2O,
故答案为:LaNi5H6+6OH--6e-=LaNi5+6 H2O.
点评 本题考查制备方案,涉及化学工艺流程、对操作与试剂的分析评价、化学方程式书写、原电池与电解原理等,是对学生综合能力的考查,需要学生具备扎实的基础与迁移运用能力,难度中等.

| A. | 4mol | B. | 8mol | C. | 16mol | D. | 24mol |
| A. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 氢氧化镁与稀硫酸反应H++OH=H2O | |
| C. | 过量的SO2通入NaOH溶液中:SO2+2OH-═SO32-+H2O | |
| D. | 大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
①CuS ②FeS ③SO3 ④H2S ⑤FeCl2.
| A. | ①③⑤ | B. | ①②③⑤ | C. | ①②④⑤ | D. | 全部 |
①FeCl2 ②H2SO4 ③NH4NO3 ④FeCl3.
| A. | 只有②③④ | B. | 只有②④ | C. | 只有①③④ | D. | 全部 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅤⅡA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 ,元素②原子核内含有6个中子的原子可表示为137N.
,元素②原子核内含有6个中子的原子可表示为137N.(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4.
(3)元素①与⑥形成的化合物的电子式为:
 .
.(4)⑤、⑥、⑨三种元素形成的简单离子,离子半径由大到小的顺序是S2->K+>Mg2+.
(5)实验室用元素③的氢化物制取③的单质的反应为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、Cl-、OH-、SO42- |
C溶液与D溶液混合只产生沉淀,B溶液与C溶液混合只产生刺激性气味的气体,A溶液与D溶液混合时无明显现象.则
(1)A为CH3COONaB为NH4Cl(写化学式)
(2)若常温下浓度为Cmol/L的A溶液中水电离出的C(H+)=10-5mol/L,则此溶液的PH=9.在此条件下,若将浓度均为2cmol/L的A与B溶液等体积混合后,所得溶液中由水电离的C(H+)>10-5mol/L( 填“>”“<”或“=”)此溶液的PH近似等于7.
(3)25C0时0.1mol/LB溶液的PH=a,则B溶液中 C(H+)-C(NH3.H2O)=10 a-14mol/L(用a表示)
(4)25C0时,在一定体积的0.005mol/L的C溶液中.加入一定体积的0.00125mol/L的盐酸混合后PH=11,若不考虑溶液体积变化,则C溶液与盐酸溶液的体积比为1:4.