题目内容
16.大气中的二氧化碳是自然界碳循环中的主要物质,请回答下列问题.(1)写出碳酸的结构式
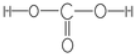 .
.(2)人类的一些工业活动会产生大量的二氧化碳,比如炼铁,请写出工业上炼铁的化学方程式:Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2.
(3)日本东北大学和东京理科大学2016年4月15日宣布,开发出了以催化剂方式使二氧化碳与二元醇直接聚合来合成聚碳酸酯的方法,请写出二氧化碳与乙二醇缩聚的反应方程式nCO2+nHO-CH2-CH2-OH→
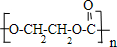 +nH2O.
+nH2O.
分析 (1)碳酸分子中,存在C=O、2个C-OH;
(2)工业上用CO和磁铁矿炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳;
(3)二氧化碳与乙二醇生成聚碳酸乙二酯.
解答 解;(1)碳酸分子中,存在C=O、2个C-OH,结构式为: ;
;
故答案为: ;
;
(2)工业上用CO和磁铁矿炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2.
故答案为:Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2;
(3)二氧化碳与乙二醇生成聚碳酸乙二酯,方程式:nCO2+nHO-CH2-CH2-OH→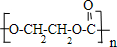 +nH2O,
+nH2O,
故答案为:nCO2+nHO-CH2-CH2-OH→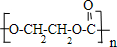 +nH2O.
+nH2O.
点评 本题考查了元素化合物知识,熟悉碳酸、二氧化碳结构及性质是解题关键,题目难度中等.

练习册系列答案
相关题目
10.下列反应属于氧化还原反应的是( )
| A. | Al(OH)3+NaOH═NaAlO2+2H2O | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | Na2O+CO2═Na2CO3 | D. | 2NaHCO3═Na2CO3+CO2↑+H2O |
11.化学与生活、社会发展息息相关,下列有关说法不正确的是( )
| A. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| B. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| C. | “玉不琢不成器”,“百炼方能成钢”发生的均为化学变化 | |
| D. | 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 |
1.下列反应的离子方程式正确的是( )
| A. | 向硫酸铝溶液中加入少量的氨水:Al3++3OH-═Al(OH) 3↓ | |
| B. | 向碳酸钠溶液中加入饱和石灰水:Ca(OH)2+CO32-═CaCO3↓+2OH- | |
| C. | 向氢氧化钠溶液中通入过量的氯气:Cl2+2OH-═ClO-+Cl-+H2O | |
| D. | 向稀硫酸中加入过量铁粉,先后发生两个反应:2Fe+6H+═2Fe3++3H2↑,Fe+2Fe3+═3Fe2+ |
5.下列转化关系中正确的是( )
| A. | SO2→SO3:2SO2+O2═2SO3 | |
| B. | Fe→Fe2+:Fe+2H+═Fe2++H2↑ | |
| C. | Cl-→Cl2:2Cl-+I2═Cl2+2I- | |
| D. | Cu→Cu(NO3)2:3Cu+8HNO3(浓)═Cu(NO3)2+NO↑+4H2O |

 .
. 外,还需含苯环的二羟基化合物F,写如有机物F与NaOH 溶液反应的离子反应方程式
外,还需含苯环的二羟基化合物F,写如有机物F与NaOH 溶液反应的离子反应方程式 ,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有 4 种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.
,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有 4 种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.