题目内容
设NA表示阿伏加德罗常数的值,下列表述不正确的是( )
| A、标准状况下,22.4L氢气所含原子数是2NA |
| B、5.4g水所含的分子数为0.3NA |
| C、1mol金属钠与水反应失去的电子数为NA |
| D、物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为NA |
考点:阿伏加德罗常数
专题:
分析:A、n=
,结合氢气分子式计算原子数;
B、依据n=
计算物质的量得到分子数;
C、钠最外层电子数为1,和水反应全部变化为钠离子;
D、溶液体积不知不能计算微粒数;
| V |
| 22.4 |
B、依据n=
| m |
| M |
C、钠最外层电子数为1,和水反应全部变化为钠离子;
D、溶液体积不知不能计算微粒数;
解答:
解:A、n=
=
=1mol,结合氢气分子式计算原子数2NA,故A正确;
B、依据n=
计算物质的量=
=0.3mol,得到分子数0.3NA,故B正确;
C、钠最外层电子数为1,和水反应全部变化为钠离子,1mol金属钠与水反应失去的电子数为NA,故C正确;
D、溶液体积不知不能计算微粒数,故D错误;
故选D.
| V |
| 22.4 |
| 22.4L |
| 22.4L/mol |
B、依据n=
| m |
| M |
| 5.4g |
| 18g/mol |
C、钠最外层电子数为1,和水反应全部变化为钠离子,1mol金属钠与水反应失去的电子数为NA,故C正确;
D、溶液体积不知不能计算微粒数,故D错误;
故选D.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积条件分析判断,物质的量计算微粒数,掌握基础是关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
向MnCl2溶液中加入过量难溶电解质MnS,可使溶液中含有的Cu2+、Pb2+、Cd2+等金属离子转化为硫化物沉淀,从而得到纯净的MnCl2.下列分析正确的是( )
| A、MnS具有吸附性 |
| B、MnS有还原性,将Cu2+、Pb2+、Cd2+还原后除去 |
| C、MnS溶液度大于CuS、PbS、CdS |
| D、MnS与Cu2+反应的离子方程式是Cu2++S2-=CuS↓ |
已知X、Y、Z、W是原子序数依次增大的短周期主族元素,X元素的最高价与最低负价代和等于2,Y的核电荷数是X的2倍,Z原子的K层和M层电子数之和与L层的电子数相等.下列说法不正确的是( )
| A、原子半径Y>Z>W |
| B、Y氧化物属于酸性氧化物 |
| C、对应的氢化物的热稳定性:W>Z |
| D、X的最高价氧化物对应的水化物弱酸 |
下列表述正确的是( )
A、氢氧根离子的电子式是 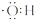 |
B、二氧化碳分子的比例模型是  |
| C、芳香烃的组成通式是CnH2n-6(n≥6) |
D、12C和14C的原子结构示意图均可表示为  |
设nA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、1mol Fe与足量的稀硝酸反应,转移3nA个电子 |
| B、常温下,16g CH4含有8nA个电子(相对原子质量:C-12,H-1) |
| C、0.5 mol?L-1Na2CO3溶液中含有nA个Na+ |
| D、标准状况下,22.4L氯水含有nA个Cl2分子 |
下列叙述中,正确的是( )
| A、H2O的摩尔质量是18 |
| B、等质量的O2和O3中所含的氧原子数相同 |
| C、常温下,22.4LNO2中所含的氧原子数为2NA |
| D、4gNaOH溶解于500mL水中,所得溶液的物质的量浓度为0.2mol?L-1 |
下列关于氯气或氯的化合物的叙述不正确的是( )
| A、过量的铁粉与氯气反应生成FeCl3 |
| B、少量SO2通入Ca(ClO)2溶液生成CaSO3沉淀 |
| C、氯气能使润湿的淀粉碘化钾试纸变蓝 |
| D、次氯酸钙比次氯酸稳定 |
某同学在配制500mL 0.5mol/LNaCl溶液的实验过程中,除用到天平、玻璃棒、烧杯、量筒、胶头滴管、试剂瓶之外,还需要的主要仪器有( )
| A、酒精灯 | B、蒸发皿 |
| C、500mL容量瓶 | D、温度计 |
