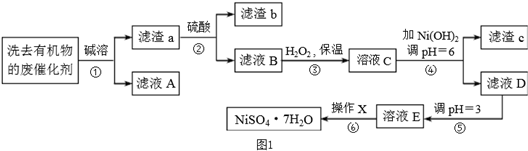
题目内容
已知X、Y、Z、W是原子序数依次增大的短周期主族元素,X元素的最高价与最低负价代和等于2,Y的核电荷数是X的2倍,Z原子的K层和M层电子数之和与L层的电子数相等.下列说法不正确的是( )
| A、原子半径Y>Z>W |
| B、Y氧化物属于酸性氧化物 |
| C、对应的氢化物的热稳定性:W>Z |
| D、X的最高价氧化物对应的水化物弱酸 |
考点:原子结构与元素周期律的关系
专题:
分析:X、Y、Z、W是原子序数依次增大的短周期主族元素,X元素的最高价与最低负价代和等于2,则X属于第VA族元素,Y的核电荷数是X的2倍,且X和Y都是短周期主族元素,则X是N元素、Y是Si元素;
Z原子的K层和M层电子数之和与L层的电子数相等,则M层电子数是6,为S元素,W属于短周期主族元素且原子序数大于Z,所以W是Cl元素,
A.电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
B.Y是Si元素,二氧化硅属于酸性氧化物;
C.元素的非金属性越强,其气态氢化物越稳定;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强.
Z原子的K层和M层电子数之和与L层的电子数相等,则M层电子数是6,为S元素,W属于短周期主族元素且原子序数大于Z,所以W是Cl元素,
A.电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
B.Y是Si元素,二氧化硅属于酸性氧化物;
C.元素的非金属性越强,其气态氢化物越稳定;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强.
解答:
解:X、Y、Z、W是原子序数依次增大的短周期主族元素,X元素的最高价与最低负价代和等于2,则X属于第VA族元素,Y的核电荷数是X的2倍,且X和Y都是短周期主族元素,则X是N元素、Y是Si元素;
Z原子的K层和M层电子数之和与L层的电子数相等,则M层电子数是6,为S元素,W属于短周期主族元素且原子序数大于Z,所以W是Cl元素,
A.电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,Y是Si元素、Z是S元素、W是Cl元素,且属于同一周期元素、原子序数依次增大,所以原子半径Y>Z>W,故A正确;
B.Y是Si元素,二氧化硅能和强碱反应生成盐和水,所以属于酸性氧化物,故B正确;
C.非金属性W>Z,所以气态氢化物的稳定性W>Z,故C正确;
D.N元素非金属性越强,其最高价氧化物的水化物硝酸是强酸,故D错误;
故选D.
Z原子的K层和M层电子数之和与L层的电子数相等,则M层电子数是6,为S元素,W属于短周期主族元素且原子序数大于Z,所以W是Cl元素,
A.电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,Y是Si元素、Z是S元素、W是Cl元素,且属于同一周期元素、原子序数依次增大,所以原子半径Y>Z>W,故A正确;
B.Y是Si元素,二氧化硅能和强碱反应生成盐和水,所以属于酸性氧化物,故B正确;
C.非金属性W>Z,所以气态氢化物的稳定性W>Z,故C正确;
D.N元素非金属性越强,其最高价氧化物的水化物硝酸是强酸,故D错误;
故选D.
点评:本题考查原子结构、元素周期律的关系,侧重考查元素周期律的综合应用,正确推断元素是解本题关键,知道元素非金属性与其氢化物的稳定性、最高价氧化物的水化物酸性强弱关系,题目难度中等.

练习册系列答案
相关题目
下列实验现象描述正确的是( )
| A、氢气在氯气中燃烧生成绿色烟雾 |
| B、碘水中加入少量汽油振荡静置后,下层液体为红色 |
| C、将无色的NO气体与空气混合时,看见气体变为红棕色 |
| D、向FeCl2溶液中滴入KSCN溶液,溶液变为血红色 |
下列实验事实不能用平衡移动原理解释的是( )
A、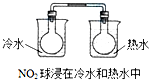 | ||||||||
B、
| ||||||||
C、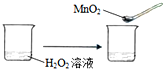 | ||||||||
D、
|
下列措施能明显增大原反应的化学反应速率的是( )
| A、Na与水反应时增大水的用量 |
| B、将稀H2SO4改为98%的浓H2SO4与Zn反应制取H2 |
| C、在H2SO4与NaOH两溶液反应时,增大压强 |
| D、恒温恒容条件下,在工业合成氨反应中,增加氮气的量 |
设NA表示阿伏加德罗常数的值,下列表述不正确的是( )
| A、标准状况下,22.4L氢气所含原子数是2NA |
| B、5.4g水所含的分子数为0.3NA |
| C、1mol金属钠与水反应失去的电子数为NA |
| D、物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为NA |